Классическая гомоцистинурия: этиология, клинические проявления и методы лечения
Классическая гомоцистинурия – это редкое аутосомно-рецессивное заболевание, связанное с нарушением обмена метионина. Причиной заболевания являются мутации гена CBS, кодирующего цистатион-β-синтазу (CbS), которая участвует в транcсульфурации гомоцистеина, образующегося из метионина. В результате недостаточности фермента увеличивается содержание гомоцистеина, который оказывает токсическое действие на различные ткани, в частности вызывает эндотелиальную дисфункцию и увеличивает риск тромбообразования. Проявления классической гомоцистинурии включают в себя эктопию хрусталиков и/или тяжелую миопию, поражение скелета (марфаноподобная внешность, остеопороз и деформация костей), нарушение умственного развития, судороги, психические и поведенческие расстройства, венозные и артериальные тромбозы. Последние могут быть единственным проявлением заболевания у части взрослых пациентов с более легкими его формами. Диагноз классической гомоцистинурии подтверждают при биохимическом (увеличение содержания гомоцистеина и метионина в плазме и снижения уровня цистатиона) и молекулярно-генетическом (гомозиготные и компаунд-гетерозиготные мутации гена CBS) исследованиях. С целью снижения содержания гомоцистеина в плазме, необходимого для профилактика развития и прогрессирования заболевания, в том числе тромботических осложнений, применяют диету с ограничением потребления метионина, витамин В6, фолиевую кислоту и бетаин.
С.В. Моисеев. Гомоцистинурия – это редкое аутосомно-рецессивное наследственное заболевание, которое относится к аминоацидопатиям. Последние представляют собой нарушения обмена аминокислот, связанные с генетически детерминированной недостаточностью функции определенных ферментов [1]. При гомоцистинурии нарушается обмен метионина, что приводит к увеличению содержания промежуточного продукта его метаболизма – гомоцистеина, который оказывает токсическое действие на различные ткани, в частности вызывает эндотелиальную дисфункцию и увеличивает риск тромбообразования. Симптомы гомоцистинурии появляются в детском возрасте и включают в себя эктопию хрусталика, т.е. его полное (вывих) или частичное (подвывих) смещение, нарушения интеллекта, остеопороз и изменения скелета. При более легких формах заболевания эти проявления могут отсутствовать, однако возможно развитие тромбозов в зрелом возрасте [2,3].
Помимо гомоцистинурии аминоацидопатии включают в себя фенилкетонурию, алкаптонурию, цитруллинемию, гистидинемию, тирозинемию, глицинемию и др. Возможно патогенетическое лечение некоторых аминоацидопатий, в том числе гомоцистинурии, что определяет важность их своевременной диагностики, в частности путем скрининга среди новорожденных. Каковы механизмы развития гомоцистинурии?
Н.В. Чеботарева. Чтобы понять патогенез гомоцистинурии, необходимо иметь представление о путях обмена метионина, которые в упрощенном виде приведены на рис. 1. Метионин превращается в гомоцистеин через S-аденозилметионин (SAM) и S-аденозилгомоцистеин (SAH) с высвобождением метильной группы, которая используется в многочисленных реакциях метилирования. В свою очередь, гомоцистеин подвергается транссульфурации с образованием цистеина под действием двух ферментов – цистатион-β-синтазы (CbS) и цистатион-γ-лиазы. Альтернативным путем метаболизма гомоцистеина является реметилирование до метионина. В этом случае донорами метильной группы могут быть 5-метилтетрагидрофолат (эта реакция катализируется метионинсинтетазой, а кофактором является метилкобаламин) или бетаин (особенно у пациентов, получающих этот препарат). Гомоцистеин находится в плазме в различных химических формах, в том числе в связанной с белками (более 80%) и свободной (2%), а также в виде дисульфидов, включая гомоцистин (10-15%) [4]. В высоких концентрациях гомоцистеин оказывает неблагоприятное действие на нервные клетки, сосудистые эндотелиальные клетки, остеобласты, остеокласты и др., что связывают с усилением оксидативного стресса, нарушением перекрестного связывания молекул коллагена, накоплением конечных продуктов гликирования и другими механизмами [5-7].
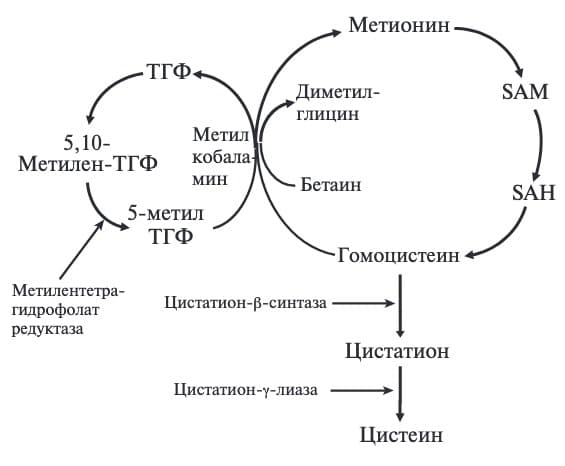
При гомоцистинурии причиной накопления гомоцистеина может быть снижение активности CbS, участвующей в транссульфурации гомоцистеина. CbS является пиридоксин (В6) зависимым ферментом, а в зависимости от ответа на пиридоксин выделяют B6зависимую и B6-резистентную формы заболевания [3]. Увеличение содержания гомоцистеина может быть также обусловлено нарушением его реметилирования вследствие снижения активности 5,10-метиленгидрофолатредуктазы и нарушений обмена кобаламина (витамина В12) [8]. 5,10-метиленгидрофолатредуктаза превращает 5,10-метилентетрагидрофолат в 5-метилтетрагидрофолат, который является биологически активной формой витамина В9. Последний действует в качестве донора метильной группы и вместе с витамином В12 участвует в превращении гомоцистеина в метионин. Нарушения метаболизма кобаламина могут быть следствием снижения его потребления с пищей и всасывания в кишечнике, нарушения транспорта транскобаламином или внутриклеточного метаболизма. Классической называют гомоцистинурию, связанную со снижением активности CbS [3].
Причиной развития классической гомоцистинурии являются гомозиготные или компаунд-гетерозиготные мутации (в основном миссенс) гена CBS, который находится на длинном плече хромосомы 21 (21q22) и кодирует соответствующий фермент (CbS) [9]. В настоящее время известно более 160 патогенных мутаций этого гена. В европейских популяциях наиболее распространенной считают мутацию c.833T>C (p.I278T), доля которой среди всех мутаций, сопровождающихся снижением активности CbS, превышает 20% [10]. В некоторых популяциях повторно определялись и другие мутации гена CBS, в том числе c.919G>A (p.G307S) в Ирландии [11], c.572C>T (p.T191M) в Испании, Португалии и Южной Америке [12,13] и c.1006C>T (p.R336C) в Катаре [14]. В гомозиготной форме эти мутации вызывают тяжелую B6-резистентную гомоцистинурию.
С.В. Моисеев. Как часто встречается гомоцистинурия?
П.И. Новиков. Гомоцистинурия встречается редко, хотя данные о ее эпидемиологии, как и других орфанных заболеваний, противоречивые и часто заниженные, в том числе вследствие возможного наличия легких или бессимптомных форм, которые реже диагностируются в клинической практике. В разных исследованиях распространенность гомоцистинурии варьировалась от 1:1800 до 1:900 000 в зависимости от метода анализа (скрининг среди новорожденных или количество диагностированных случаев) [2]. Учитывая аутосомнорецессивный тип наследования, частота гомоцистинурии выше в странах, в которых распространены браки среди родственников. Например, в Катаре она достигла 1:1800 [14]. В США предполагаемая распространенность классической гомоцистинурии составляет 1 : 100 000-200 000, хотя результаты недавно опубликованного исследования свидетельствуют о том, что фактически она по крайней мере в 10 раз выше и может достигать 1 : 10 000 [15]. Классическую гомоцистинурию обычно диагностируют педиатры на основании типичных клинических проявлений и результатов лабораторных исследований, в частности повышения уровня гомоцистеина в крови. Тем не менее, это заболевание имеет значение и для врачей, наблюдающих взрослых пациентов, так как, с одной стороны, больные обычно доживают до взрослого возраста, а, с другой стороны, возможна и поздняя диагностика гомоцистинурии, прежде всего при отсутствии некоторых характерных проявлений или малосимптомном течении болезни. За последние несколько лет в клинике им. Е.М. Тареева были обследованы двое взрослых пациентов с классической гомоцистинурией, которые ранее находились под наблюдением педиатров.
Е.Е. Филатова. Пациент К., 18 лет, обследован в клинике в июле 2022 года. В возрасте 7 лет выявлена близорукость, которая нарастала с возрастом. Наблюдался у офтальмолога с диагнозом миопии высокой степени, амблиопии и подвывиха обоих хрусталиков. В возрасте 14 лет (2018 г.) выявлен остеопороз костей, по поводу которого проводились инфузии памедроновой кислоты. Одна инфузия осложнилась развитием тромбоза вены руки. Перенес несколько переломов, в том числе лучевой кости, указательного пальца левой кисти и бедренной кости в возрасте 5, 11 и 14 лет, соответственно. В 2018 году при обследовании выявлено увеличение сывороточного содержания гомоцистеина до 395,5 мкмоль/л (в норме 5,0-7,0) и метионина до 159,7 мкмоль/л (в норме до 70 мкмоль/л). Проба с пиридоксином положительная. Диагностирована классическая гомоцистинурия, диагноз которой был подтвержден при молекулярно-генетическом исследовании (гомозиготная мутация гена CBS c.12242A>C). С этого же времени фокальная эпилепсия со вторично-генерализованными судорожными приступами, в связи с чем проводилось лечение леветирацетамом в дозе 150 мг два раза в день. В ноябре 2019 года обследован в институте педиатрии им. Ю.Е. Вельтищева. При осмотре отмечались правосторонний сколиоз позвоночника, сгибательная установка левой голени, разгибательная установка правой голени, сгибательные установки пальцев кистей, разгибательные установки бедер, килевидная деформация грудной клетки, укорочение правой ноги на 2,5 см. Подтвержден диагноз гомоцистинурии. С 2019 г. в дополнение к витамину В6, фолиевой кислоте и диете с ограничением метионина проводилась терапия безводным бетаином в дозе 6,5 г/сут, хотя получал препарат с перерывами, а достичь стойкого снижения содержания гомоцистеина в плазме не удавалось. В апреле 2021 г. удалены оба хрусталика и установлены искусственные линзы.
П.И. Новиков. Клинические проявления классической гомоцистинурии можно разделить на несколько групп [2,3]:- орган зрения: эктопия хрусталиков и/или тяжелая миопия;
- скелет: высокий рост и длинные конечности (марфаноподобная внешность), остеопороз и деформация костей (вальгусная установка коленных суставов, кифосколиоз, воронкообразная или килевидная деформация грудной клетки);
- центральная нервная система (ЦНС): нарушение умственного развития, судороги, психические и поведенческие расстройства и экстрапирамидные нарушения;
- тромбозы и тромбоэмболии.
Представленное наблюдение иллюстрирует большинство типичных проявлений классической гомоцистинурии, включая миопию и эктопию хрусталиков, потребовавшую оперативного лечения, остеопороз, осложнившийся несколькими переломами, изменения скелета, судорожный синдром, венозный тромбоз. Характерный симптом гомоцистинурия – эктопия хрусталиков, которой может предшествовать прогрессирующая близорукость. При наличии подвывиха хрусталиков у ребенка следует всегда исключать классическую гомоцистинурию [2]. S. Mudd и соавт. обобщили результаты обследования 629 пациентов с классической гомоцистинурией [16]. Как видно из рис. 2, в 86% случаев эктопия хрусталиков была одним из симптомов, которые позволяли врачам заподозрить этот диагноз и провести необходимые исследования. Другими частыми проявлениями классической гомоцистинурии у детей были умственная отсталость и задержка психомоторного развития, которые отмечались у второго пациента, обследованного в нашей клинике.
![Рис. 2. Проявления классической гомоцистинурии, которые позволили врачам заподозрить этот диагноз (% больных) [16]](/wp-content/uploads/2022/10/klasicheskaya-gomotsistinuriya-etiologiya-klinicheskie-proyavleniya-i-metody-lecheniya_fig2.jpg)
Е.М. Щеголева. Пациент Л., 19 лет, находился в клинике им. Е.М. Тареева в апреле 2021 г. С рождения отмечались задержка психомоторного и физического развития, а также диспептические расстройства (рвота и диарея). Начал говорить в возрасте 4 лет. При офтальмологическом обследовании выявлен подвывих обоих хрусталиков. В 2011 г. в возрасте 9 лет заподозрена гомоцистинурия, в связи с чем получал диету с ограничением метионина, на фоне которой улучшились аппетит и сон, прекратились эпизоды рвоты и диареи. С 2012 г. наблюдается в институте педиатрии им. Ю.Е. Вельтищева. Был подтвержден диагноз гомоцистинурии с учетом повышения уровней метионина и гомоцистеина в плазме и наличия двух мутаций гена CBS (IVS112a->c и c.216-217delAT). В 2013-2014 гг. поэтапно проведена замена обоих хрусталиков искусственными линзами. С 2016 г. получает терапию пиридоксином (витамином В6). В 2017 г. при ультразвуковом допплеровском исследовании выявлены умеренные диффузные изменения стенок брахиоцефальных артерий на экстракраниальном уровне со стенозирующим поражением проксимального отдела правой внутренней сонной артерии. При рентгенографии в двух проекциях определялся правосторонний сколиоз 2 степени с выраженными дистрофическими изменениями. Содержание гомоцистеина в крови составляло 243,0 мкмоль/л, метионина – 365,8 мкМ/л. С мая 2019 г. начата терапия бетаином в дозе 100 мг/кг/сут, в результате чего содержание гомоцистеина в крови снизилось до 149 мкмоль/л. Однако лечение проводилось с перерывами в связи с отсутствием препарата в регионе. При обследовании в клинике в апреле 2021 г. обращали на себя внимание умеренная умственная отсталость, а также сколиоз позвоночника, вальгусная деформация нижних конечностей, варусная деформация правой стопы, укорочение левой ноги на 2,0 см. При денситометрии выявлен тяжелый остеопороз позвоночника. Уровень гомоцистеина в крови составлял 290 мкмоль/л, в связи с чем рекомендовано возобновить и не прерывать терапию бетаином. Учитывая наличие остеопороза, назначена золендроновая кислота.
Т.П. Шевцова. В представленном наблюдении предположить диагноз классической гомоцистинурии позволяли эктопия хрусталиков, задержка развития и изменения скелета, которые отмечались уже в раннем детском возрасте. К числу наиболее опасных проявлений классической гомоцистинурии относятся тромбозы, которые в упомянутом выше исследовании у 625 пациентов были одной из основных причин смерти в молодом возрасте [16]. В этом исследовании в целом были зарегистрированы 253 случая тромбоза у 158 больных, т.е. у каждого четвертого пациента. В 51% случаев отмечался тромбоз глубоких вен, в 32% – инсульт (в том числе связанный с тромбозом венозного синуса), в 11% – тромбоз периферических артерий и в 4% – инфаркт миокарда. К 16-летнему возрасту вероятность тромбоэмболических осложнений составляла около 25%, а к 30-летнему – достигла 50%. Таким образом, тромбозы и тромбоэмболические осложнения при классической гомоцистинурии могут развиться в детском возрасте, но чаще наблюдаются у взрослых, в том числе при отсутствии других типичных проявлений классической гомоцистинурии [17]. Дополнительным фактором риска тромбообразования может служить сопутствующая тромбофилия, например, мутация гена фактора V (фактора Лейдена) [18,19].
Гипергомоцистеинемия, обусловленная не только классической гомоцистинурией, но и другими причинами, является установленным фактором риска сердечнососудистых исходов. По данным мета-анализа 10 исследований случай-контроль или когортных исследований в целом у 10103 участников, увеличение содержания гомоцистеина в плазме на каждые 5 мкмоль/л сопровождалось повышением риска коронарных осложнений на 22% [20]. Причинами увеличения риска сердечно-сосудистых исходов при гипергомоцистеинемии могут быть как ускоренное развитие атеросклероза, так и артериальный тромбоз (или атеротромбоз). Наиболее вероятным механизмом действия гомоцистеина на сосуды и тромбообразование считают эндотелиальную дисфункцию, связанную с ингибированием NO-синтазы на фоне окислительного стресса, и снижение выделения оксида азота эндотелиальными клетками [21], хотя важное значение могут иметь и другие нарушения, в том числе усиление пролиферации гладкомышечных клеток сосудов, образование окисленных липопротеидов низкой плотности, обладающих выраженными атерогенными свойствами, усиление адгезии и агрегации тромбоцитов, выделение провоспалительных цитокинов и др. [20].
С.В. Моисеев. Приведенные данные свидетельствуют о том, что у детей классическую гомоцистинурию следует исключать при наличии типичного поражения органа зрения, изменений скелета, включая остеопороз, и/или задержки развития, в то время как у взрослых этот диагноз необходимо обсуждать в случае развития артериальных или венозных тромбозов, особенно в молодом возрасте, в том числе при отсутствии других проявлений заболевания. В пользу такого подхода свидетельствуют результаты зарубежных исследований. В Италии при скрининге на тромбофилии тяжелая классическая гомоцистинурия была выявлена у 38 (0,2%) из 19678 пациентов с тромбозами [22]. Медиана возраста на момент установления диагноза составляла 47 лет (от 19 до 83), а медиана концентрации гомоцистеина в плазме – 130 мкмоль/л (от 101 до 262). У большинства пациентов (71%) были зарегистрированы венозные тромбоэмболические осложнения, у остальных – артериальные тромбозы. Следует отметить, что в 42% случаев наблюдались повторные тромботические осложнения. Как подтвердить диагноз классической гомоцистинурии?
Н.М. Буланов. Если предполагается диагноз классической гомоцистинурии, то в первую очередь необходимо определить содержание гомоцистеина в плазме, которое у нелеченных больных обычно превышает 100 мкмоль/л [2,3]. Среди биохимических показателей важное значение имеют также повышение содержания метионина, снижение концентрации цистатиона и увеличение отношения содержания метионина/цистатиона. Эти показатели измеряют с помощью тандемной масс-спектрометрии. В обоих представленных наблюдениях отмечалось многократное увеличение концентрации гомоцистеина в плазме, которое сопровождалось повышением содержания метионина. Необходимо учитывать, что у части больных с классической гомоцистинурией возможно умеренное увеличение концентрации гомоцистеина в плазме. Например, среди 25 пациентов с классической гомоцистинурией медиана содержания гомоцистеина в плазме составила 125 мкмоль/л, однако оно варьировалось от 16 до 281 мкмоль/л, т.е. у некоторых больных было существенно ниже 100 мкмоль/л [23]. M. Sellos-Moura и соавт. изучили частоту классической гомоцистинурии среди более 57500 американцев, у которых измеряли содержание гомоцистеина в плазме. У 1,8% из них оно превышало 30 мкмоль/л (в среднем 75,3±57,2 мкмоль/л). Среди обследованных, у которых определялась или не определялясь умеренная/выраженная гипергомоцистеинемия, частота гомоцистинурии или других нарушений обмена серосодержащих аминокислот существенно не отличалась и составила 3,8% и 4,0%, соответственно (р=0,752) [24]. Концентрация гомоцистеина в плазме может снизиться под влиянием витамина В6 (пиридоксина). У пациентов с легкой В6зависимой гомоцистинурией возможно даже снижение уровня гомоцистеина до референсных значений на фоне приема физиологических доз пиридоксина [23]. В связи с этим перед измерением содержания гомоцистеина необходимо по крайней мере на 2 недели исключить дополнительный прием пиридоксина, который входит в состав различных поливитаминов и добавляется в некоторые пищевые продукты. При наличии указанных биохимических изменений для подтверждения диагноза классической гомоцистинурии целесообразно провести молекулярно-генетическое исследование с целью выявления мутаций гена CBS. Возможно также определение активности CbS в культуре фибробластов и/или плазме [2], однако в России этот метод не используется [3].
С.В. Моисеев. В описанном выше американском исследовании классическая гомоцистинурия была диагностирована у относительно небольшой части пациентов с умеренной или выраженной гипергомоцистеинемией. Каковы другие причины увеличения концентрации гомоцистеина в плазме?
Н.В. Чеботарева. Увеличение концентрации гомоцистеина в плазме может быть вызвано различными причинами, включая хроническую почечную недостаточность, гипотиреоз, злокачественные опухоли, лечение некоторыми лекарственными препаратами, включая метотрексат, никотиновую кислоту, метформин, фибраты, недостаточное потребление витамина В12 и фолиевой кислоты, наследственные нарушения всасывания витамина В12 или реметилирования гомоцистеина [25]. В отличие от классической гомоцистинурии, при этих состояниях отмечаются снижение концентрации метионина в плазме и увеличение содержания цистатиона, который образуется из гомоцистеина под действием CbS (соответственно, при недостаточности фермента его содержание в плазме, наоборот, снижается). На практике нередкой причиной гипергомоцистеинемии является недостаточное потребление витамина В12 и реже фолиевой кислоты, для исключения дефицита которых рекомендуется измерение содержания витамина В12 и/или транскобаламина II, метилмалоновой кислоты в плазме и моче и фолиевой кислоты в сыворотке [2]. Недостаточность витаминов часто встречается у пожилых людей, поэтому частота гипергомоцистеинемии увеличивается с возрастом. У пациентов с хронической болезнью почек содержание гомоцистеина в плазме может увеличиться при снижении скорости клубочковой фильтрации менее 60 мл/мин/1,73 м2, а у больных с терминальной хронической почечной недостаточностью частота гипергомоцистеинемии достигает 85-100% [26]. Механизмы влияния лекарственных препаратов на содержание гомоцистеина в плазме могут быть связаны с нарушением всасывания витаминов в кишечнике (холестирамин и метформин) или подавлением метаболизма фолиевой кислоты (метотрексат, никотиновая кислота и фибраты) [25]. К редким причинам гомоцистинурии относятся генетически детерминированные нарушения реметилирования гомоцистеина, связанные с недостаточной активностью метионинсинтетазы или метилентетрагидрофолат редуктазы.
С.В. Моисеев. Каковы цели лечения пациентов с классической гомоцистинурией, в частности взрослых людей, у которых многие проявления заболевания, например, поражение скелета или органа зрения, являются необратимыми? Как оценить эффективность терапии?
Т.П. Шевцова. В случае ранней диагностики классической гомоцистинурии, прежде всего путем неонатального скрининга [27], реалистичной целью лечения является профилактика всех проявлений заболевания [2]. У взрослых пациентов, в том числе молодого возраста, ключевое значение имеет профилактика тромботических осложнений, которые являются одной из основных причин смертности больных с классической гомоцистинурией. S. Yap и соавт. проанализировали частоту сосудистых осложнений у 158 пациентов в возрасте в среднем 29,4 лет (36% из них были в возрасте старше 30 лет, а 6% – старше 50 лет), которые получали терапию, направленную на снижение содержания гомоцистеина в течение в среднем 18 лет [28]. В качестве контроля использовали ранее опубликованные результаты наблюдения 629 нелеченных больных с классической гомоцистинурией [16]. В результате терапии было достигнуто значительное снижение концентрации гомоцистеина в плазме, хотя она оставалась умеренно повышенной. Во время периода наблюдения были зарегистрированы 17 сосудистых событий (чаще всего венозные тромбоэмболические осложнения, реже инфаркт миокарда, инсульт и др.), в то время как ожидаемое их количество, рассчитанное на основании "исторического" контроля, составило 112. Таким образом, риск тромботических осложнений в результате лечения снизился на 91% (p<0,0001).
Непосредственным критерием эффективности терапии является содержание гомоцистеина в плазме. У пациентов с В6-зависимой формой гомоцистинурией (т.е. отвечающих на лечение пиридоксином) целевая концентрация гомоцистеина в плазме составляет <50 мкмоль/л, в то время как у больных с В6-резистентной формой заболевания приемлемым результатом считают снижение содержания гомоцистеина <100 мкмоль/л [2]. Необходимо обеспечивать адекватную приверженность к лечению и регулярно измерять содержание гомоцистеина в плазме, чтобы контролировать эффективность терапии.
С.В. Моисеев.Каковы современные подходы к лечению классической гомоцистинурии?
Е.А. Тао. CbS – это пиридоксин-зависимый фермент, поэтому у части больных с классической гомоцистинурией применение этого витамина позволяет достичь снижения уровня гомоцистеина в плазме. В самом крупном исследовании среди 625 пациентов с классической гомоцистинурией "биохимический" ответ на витамин В6, в том числе частичный, был отмечен примерно в половине случаев [16]. Для оценки чувствительности к пиридоксину у пациентов с подтвержденным диагнозом классической гомоцистинурии российские эксперты рекомендуют проводить пробу, предполагающую измерение содержания гомоцистеина и метионина до и через 24 ч после приема 100 мг витамина В6 внутрь [3]. Проба считается положительной, если содержание указанных веществ снижается по крайней мере на 30%. Если первая проба отрицательная, то ее повторяют, увеличив дозу пиридоксина до 200 мг, а затем при необходимости до 500 мг (у детей первого года жизни – не более 300 мг).
В зарубежных рекомендациях для оценки чувствительности к пиридоксину предлагается принимать его в дозе 10 мг/кг/сут (не более 500 мг/сут) в течение 6 недель на фоне обычной диеты и адекватного потребления фолиевой кислоты [2]. До пробного лечения необходимо скорректировать дефицит витамина В12, если он имеется. Концентрацию гомоцистеина в плазме измеряют по крайней мере дважды до лечения и дважды в конце лечения. Если содержание его снижается <50 мкмоль/л, то какая-либо дополнительная терапия не требуется. Если концентрация гомоцистеина снижается более чем на 20%, но остается выше 50 мкмоль/л, обоснована дополнительная терапия (например, диета и/или бетаин). Снижение содержания гомоцистеина менее чем на 20% указывает на резистентность к пиридоксину. В таких случаях, по мнению зарубежных экспертов, его длительное применение не имеет смысла. Основным побочным эффектом этого витамина является периферическая невропатия, однако она не встречалась при его применении в дозах менее 500 мг/сут. У детей первого года жизни доза пиридоксина не должна превышать 300 мг/сут, учитывая риск развития апноэ.
Пациентам с классической гомоцистинурией показана диета с ограничением потребления метионина, который является источником гомоцистеина. Чтобы предотвратить белково-энергетическую недостаточность, назначают специальные продукты питания на основе синтетических аминокислот без метионина, но обогащенные цистеином [3]. Количество пищевого метионина рассчитывается диетологом и обеспечивается за счет натуральных растительных и специальных низкобелковых продуктов. Обеспечить строгое соблюдение диеты бывает сложно, а с возрастом приверженность обычно снижается [29].
С.В. Моисеев. Обоим пациентам назначали бетаин безводный, применение которого приводило к снижению содержания гомоцистеина в плазме. Каковы механизмы действия этого препарата и результаты его клинических исследований.
Е.М. Щеголева. Бетаин безводный (Цистадан) разрешен к применению для лечения классической гомоцистинурии и гомоцистинурии, связанной со снижением активности метилентетрагидрофолатредуктазы и нарушениями обмена кобаламина. В Российской Федерации препарат не зарегистрирован, однако существует возможность его импорта для пациентов с подтвержденным диагнозом классической гомоцистинурии, не отвечающих на другие методы лечения. Бетаин образуется в организме из холина и, будучи донором метильной группой, участвует в реметилировании гомоцистеина, т.е. его превращении в метионин. Кроме того, он выступает в роли химического шаперона и частично восстанавливает фолдинг измененной CbS [30]. Бетаин применяют в дополнение к пиридоксину у пациентов с частичным ответом на витамин В6 или к диете у пациентов с В6-резистентной классической гомоцистинурией [2,3]. У детей лечевние рекомендуется начинать с дозы 50 мг/кг в два приема, а у взрослых – с дозы 3 г два раза в день. Увеличение дозы более 150-200 мг/кг/сут обычно не дает дополнительного эффекта [2].
В клинических исследованиях применение бетаина вызывало значительное снижение содержания гомоцистеина в плазме [31]. В инструкции по применению препарата обобщен опыт применения бетаина в рандомизированном контролируемом исследовании и наблюдательных исследованиях у 78 детей и взрослых с гомоцистинурией, связанной с недостаточной активностью CbS (n=48), метилентетрагидрофолатредуктазы (n=13) или нарушением обмена кобаламина (n=11) [32]. В результате лечения содержание гомоцистеина в плазме снизилось на 71-83% независимо от исходного уровня. Примерно в 3/4 случаев было отмечено клиническое улучшение, в том числе уменьшение судорог или улучшение поведения и когнитивной функции.
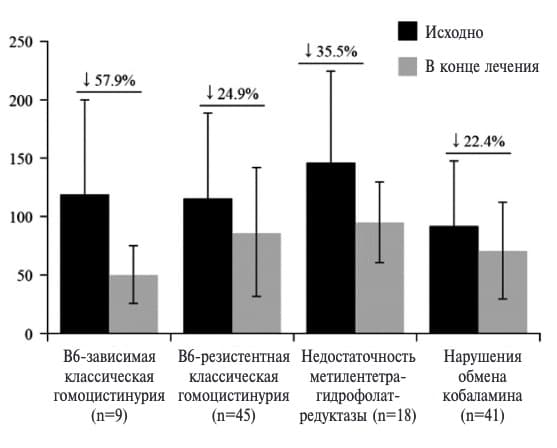
V. Valayannopoulos и соавт. изучали эффективность бетаина безводного у 125 детей и взрослых с различными формами гомоцистинурии, включенных в регистр RoCH [33]. Длительность лечения составляла в среднем 7,4±4,3 лет. У пациентов с классической гомоцистинурией медиана дозы бетаина составляла 6 г/сут, однако у больных с В6-резистентной формой заболевания она была увеличена до 9 г/сут. Большинство больных получали также витамины В6 и В12 и фолиевую кислоту, а пациенты с В6-резистентной формой заболевания (87,8%), как правило, соблюдали диету с ограничением метионина. Средний уровень гомоцистеина в плазме к концу наблюдения во всей выборке снизился с 111,3±70,3 до 79,1±46,5 мкмоль/л. Наиболее выраженный эффект был достигнут у 9 пациентов с В-зависимой классической гомоцистинурией, у которых содержание гомоцистеина в плазме снизилось в среднем на 57,9% (рис. 3). У 45 пациентов с В-резистентной классической гомоцистинурией концентрация гомоцистеина в плазме снизилась в среднем 24,9%. У пациентов с классической гомоцистинурией было повышено исходное содержание метионина в плазме. При В6резистентной форме на фоне лечения отмечалось незначительное дальнейшее его увеличение, однако концентрация метионина во всех случаях была существенно ниже опасного уровня (1000 мкмоль/л). Результаты этого исследования подтвердили, что применение бетаина безводного в дополнение к другим методам лечения позволяет достичь целевого уровня гомоцистеина в плазме у большинства пациентов с классической гомоцистинурией. Сходные результаты приводят и другие авторы [34]. Необходимо подчеркнуть, что результаты лечения классической гомоцистинурии в значительной степени зависят от приверженности к терапии. В представленных нами наблюдениях врачам не удавалось достичь стойкого снижения содержания гомоцистеина в плазме, что было следствием перерывов в применении бетаина, связанных с отсутствием препарата. При этом сохранение высокой гомоцистеинемии повышает риск тромбоэмболических осложнений, которые являются одной из основных причин смертности больных.
С.В. Моисеев. Классическая гомоцистинурия – это редкое наследственное заболевание, хотя истинная его распространенность может значительно превышать предполагаемые показатели, прежде всего за счет малосимптомных форм. Тяжелая гомоцистинурия у детей проявляется типичным поражением органа зрения (эктопия хрусталиков и миопия), деформацией скелета, остеопорозом и задержкой развития, позднее нередко развиваются тромботические осложнения, в том числе венозные (тромбоз глубоких вен, тромбоэмболия легочной артерии) и реже артериальные (инсульт, инфаркт миокарда). У взрослых пациентов тромбозы и эмболии могут быть единственным проявлением классической гомоцистинурии. Основным скрининговым показателем является увеличение содержания гомоцистеина в плазме, которое обычно превышает 100 мкмоль/л. Для подтверждения диагноза необходимо провести молекулярно-генетическое исследование с целью выявления мутаций гена CBS. Лечение классической гомоцистинурии направлено на снижение содержания гомоцистеина в плазме до целевого уровня. С этой целью применяют диету с ограничением потребления метионина, витамин В6, фолиевую кислоту, а также бетаин безводный, который способствует реметилированию гомоцистеина до метионина.
Используемые источники
- Wasim M, Awan FR, Khan HN, et al. Aminoacidopathies: prevalence, etiology, screening, and treatment options. Biochem Genet 2018;56(1-2):7-21.
- Morris AA, Kožich V, Santra S, et al. Guidelines for the diagnosis and management of cystathionine beta-synthase deficiency. J Inherit Metab Dis 2017;40(1):49-74.
- Баранов А.А., Намазова-Баранова Л.С., Боровик Т.Э. и др. Гомоцистинурия у детей. Вопросы современной педиатрии 2017;16(6):457-67 [Baranov AA, Namazova-Baranova LS, Borovik TE, et al. Homocystinuria in children. Current Pediatrics 2017;16(6):457-67 (In Russ.)].
- Rasmussen K, Mњller J. Total homocysteine measurement in clinical practice. Ann Clin Biochem 2000;37 ( Pt 5):627-48.
- Saito M, Marumo K. The effects of homocysteine on the skeleton. Curr Osteoporos Rep 2018;16(5):554-60.
- Lehotský J, Tothová B, Kovalská M, et al. Role of homocysteine in the ischemic stroke and development of ischemic tolerance. Front Neurosci 2016;10:538.
- Guieu R, Ruf J, Mottola G. Hyperhomocysteinemia and cardiovascular diseases. Ann Biol Clin (Paris) 2022;80(1):7-14.
- Huemer M, Diodato D, Schwahn B, et al. Guidelines for diagnosis and management of the cobalamin-related remethylation disorders cblC, cblD, cblE, cblF, cblG, cblJ and MTHFR deficiency. J Inherit Metab Dis. 2017;40:21–48.
- Гомоцистинурия у детей. Клинические рекомендации. 2016 г.
- Skovby F, Gaustadnes M, Mudd SH. A revisit to the natural history of homocystinuria due to cystathionine beta-synthase deficiency. Mol Genet Metab 2010;99(1):1-3.
- Yap S, Naughten E. Homocystinuria due to cystathionine beta-synthase deficiency in Ireland: 25 years' experience of a newborn screened and treated population with reference to clinical outcome and biochemical control. J Inherit Metab Dis 1998;21(7):738-47.
- Cozar M, Urreizti R, Vilarinho L, et al. Identification and functional analyses of CBS alleles in Spanish and Argentinian homocystinuric patients. Hum Mutat 2011;32(7):835-42.
- Alcaide P, Krijt J, Ruiz-Sala P, et al. Enzymatic diagnosis of homocystinuria by determination of cystathionine-synthase activity in plasma using LC-MS/MS. Clin Chim Acta 2015;438:261-5.
- Gan-Schreier H, Kebbewar M, Fang-Hoffmann J, et al. Newborn population screening for classic homocystinuria by determination of total homocysteine from Guthrie cards. J Pediatr 2010;156(3):427-32.
- Sellos-Moura M, Glavin F, Lapidus D. et al. Prevalence, characteristics, and costs of diagnosed homocystinuria, elevated homocysteine, and phenylketonuria in the United States: a retrospective claims-based comparison. BMC Health Serv Res 20202;20:183.
- Mudd SH, Skovby F, Levy HL, et al. The natural history of homocystinuria due to cystathionine beta-synthase deficiency. Am J Hum Genet 1985;37(1):1-31.
- Magner M, KrupkovЗ L, HonzТk T, et al. Vascular presentation of cystathionine beta-synthase deficiency in adulthood. J Inherit Metab Dis 2011;34(1):33-7.
- Mandel H, Brenner B, Berant M, et al. Coexistence of hereditary homocystinuria and factor V Leiden--effect on thrombosis. N Engl J Med 1996;334(12):763-8.
- Awan Z, Aljenedil S, Rosenblatt DS, et al. Severe hyperhomocysteinemia due to cystathionine β-synthase deficiency, and factor V Leiden mutation in a patient with recurrent venous thrombosis. Thromb J 2014;12(1):30.
- Wang B, Mo X, Wu Z, Guan X. Systematic review and meta-analysis of the correlation between plasma homocysteine levels and coronary heart disease. J Thorac Dis 2022;14(3):646-53.
- Esse R, Barroso M, Tavares de Almeida I, et al. The contribution of homocysteine metabolism disruption to endothelial dysfunction: state-of-the-art. Int J Mol Sci 2019;20:867.
- Lussana F, Betti S, D'Angelo A, et al. Evaluation of the prevalence of severe hyperhomocysteinemia in adult patients with thrombosis who underwent screening for thrombophilia. Thromb Res 2013;132(6):681-4.
- Stabler SP, Korson M, Jethva R, et al. Metabolic profiling of total homocysteine and related compounds in hyperhomocysteinemia: utility and limitations in diagnosing the cause of puzzling thrombophilia in a family. JIMD Rep 2013;11:149-63.
- Sellos-Moura M, Glavin F, Lapidus D, et al. Estimated prevalence of moderate to severely elevated total homocysteine levels in the United States: A missed opportunity for diagnosis of homocystinuria? Mol Genet Metab 2020;130(1):36-40.
- Kim J, Kim H, Roh H, Kwon Y. Causes of hyperhomocysteinemia and its pathological significance. Arch Pharm Res 2018;41(4):372-83.
- van Guldener C. Why is homocysteine elevated in renal failure and what can be expected from homocysteine-lowering? Nephrol Dial Transplant 2006;21:1161-6.
- Huemer M, Kožich V, Rinaldo P, et al. Newborn screening for homocystinurias and methylation disorders: systematic review and proposed guidelines. J Inherit Metab Dis 2015;38(6):1007-19.
- Yap S, Boers GH, Wilcken B, et al. Vascular outcome in patients with homocystinuria due to cystathionine beta-synthase deficiency treated chronically: a multicenter observational study. Arterioscler Thromb Vasc Biol 2001;21:2080-5.
- Adam S, Almeida MF, Carbasius Weber E, et al. Dietary practices in pyridoxine non-responsive homocystinuria: a European survey. Mol Genet Metab 2013;110(4):454-9.
- Kopecka J, Krijt J, Rakova K, Kozich V. Restoring assembly and activity of cystathionine beta-synthase mutants by ligands and chemical chaperones. J Inherit Metab Dis 2011;34:39-48.
- Wilcken DE, Wilcken B, Dudman NP, Tyrrell PA. Homocystinuria - the effects of betaine in the treatment of patients not responsive to pyridoxine. N Engl J Med 1983;309(8):448-53.
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2010/020576s010lbl.pdf.
- Valayannopoulos V, Schiff M, Guffon N, et al. Betaine anhydrous in homocystinuria: results from the RoCH registry. Orphanet J Rare Dis 2019;14(1):66.
- Mütze U, Gleich F, Garbade SF, et al. Postauthorization safety study of betaine anhydrous. J Inherit Metab Dis. 2022 Mar 31. doi: 10.1002/jimd.12499.
