Новые перспективы медикаментозной терапии хронической ишемии головного мозга с позиций нейровоспаления
Высокая частота инсульта во всем мире требует пересмотра современной доктрины ведения больных с цереброваскулярной патологией. В частности, очевидно, что только агрессивная коррекция факторов риска сосудистой патологии не позволяет гарантированно предотвратить острое нарушение мозгового кровообращения, которое является промежуточной или конечной стадией цереброваскулярной патологии. В связи с этим применение в клинической практике нейропротекторов, к которым относится винпоцетин, является аргументированным решением проблемы повышения толерантности мозговой ткани к гипоксии. Винпоцетин, производное алкалоида винкамина, широко используется во многих странах для лечения цереброваскулярных заболеваний, в том числе хронической ишемии головного мозга (ХИМ). Основной механизм действия препарата традиционно связывают с ингибированием фосфодиэстеразы и потенциалзависимых Na+-каналов. Недавние исследования показали ряд новых терапевтических эффектов винпоцетина, в том числе стимуляцию нейропластичности за счет влияния на мозговой нейротрофический фактор и ингибирования нейровоспаления. Последний механизм реализуется путем воздействия на NF-kB, что подавляет экспрессию NF-kB-зависимых провоспалительных молекул и препятствует формированию NLRP3 инфламмасомы. Эти данные позволяют по-новому оценить эффективность нейропротекторов, используемых для профилактики и лечения цереброваскулярных расстройств.
Хроническая ишемия головного мозга (ХИМ), или дисциркуляторная энцефалопатия, является одной из наиболее обсуждаемых в профессиональных кругах неврологических проблем. Это связано, прежде всего, с широкой распространенностью данной патологии. По данным Министерства Здравоохранения РФ [1], в нашей стране в 2017 г. количество пациентов с диагнозом "Другие цереброваскулярные заболевания" составило более 5500 человек на 100 тыс взрослого населения. До настоящего времени точные патофизиологические механизмы поражения вещества головного мозга при данном заболевании остаются неизвестными. Доминировавшая ранее концепция о персистирующей церебральной гипоперфузии вследствие локальных стенозов магистральных артерий уступила место концепции микроангиопатии (так называемой "болезни малых сосудов"). Предполагается, что при данной патологии под воздействием внешних факторов риска, а также вследствие генетически детерминированной толерантности мозговой ткани к гипоксии возникает многоочаговое или диффузное поражение головного мозга с формированием триады ведущих симптомов – когнитивных нарушений, постуральной неустойчивости и аффективных расстройств.
Одним из наименее исследованных механизмов развития клинических проявлений ХИМ является нейровоспаление – персистирующий субклинический воспалительный процесс в веществе головного мозга, возникающий в ответ на разрушение цитоскелета нейронов. Ранее предполагалось, что нейровоспаление реализуется через цитотоксический ответ клеток микроглии и окислительный стресс, однако в настоящее время фокус большинства исследований в этой области сместился на изучение астроглиальной активации, сопровождающейся локальной гиперпродукцией цитокинов и формированием внутриклеточных комплексов (инфламмасом). Традиционно "визитной карточкой" нейровоспаления считают экспонентное интракраниальное увеличение синтеза провоспалительных цитокинов, главным образом интерлейкина-1 (ИЛ-1), интерлейкина-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α), хемокинов (CCL2, CCL5, CXCL1), индукцию экспрессии молекул адгезии, активацию ряда ферментов (индуцибельной NO-синтетазы, циклооксигеназы, миелопероксидазы и др.), а также образование низкомолекулярных медиаторов воспаления (оксида азота, реактивных форм кислорода, эйкозаноидов и др.). Этот патофизиологический каскад приводит к повреждению гематоэнцефалического барьера и в дальнейшем индуцирует нейрональный апоптоз и глиоз [2].
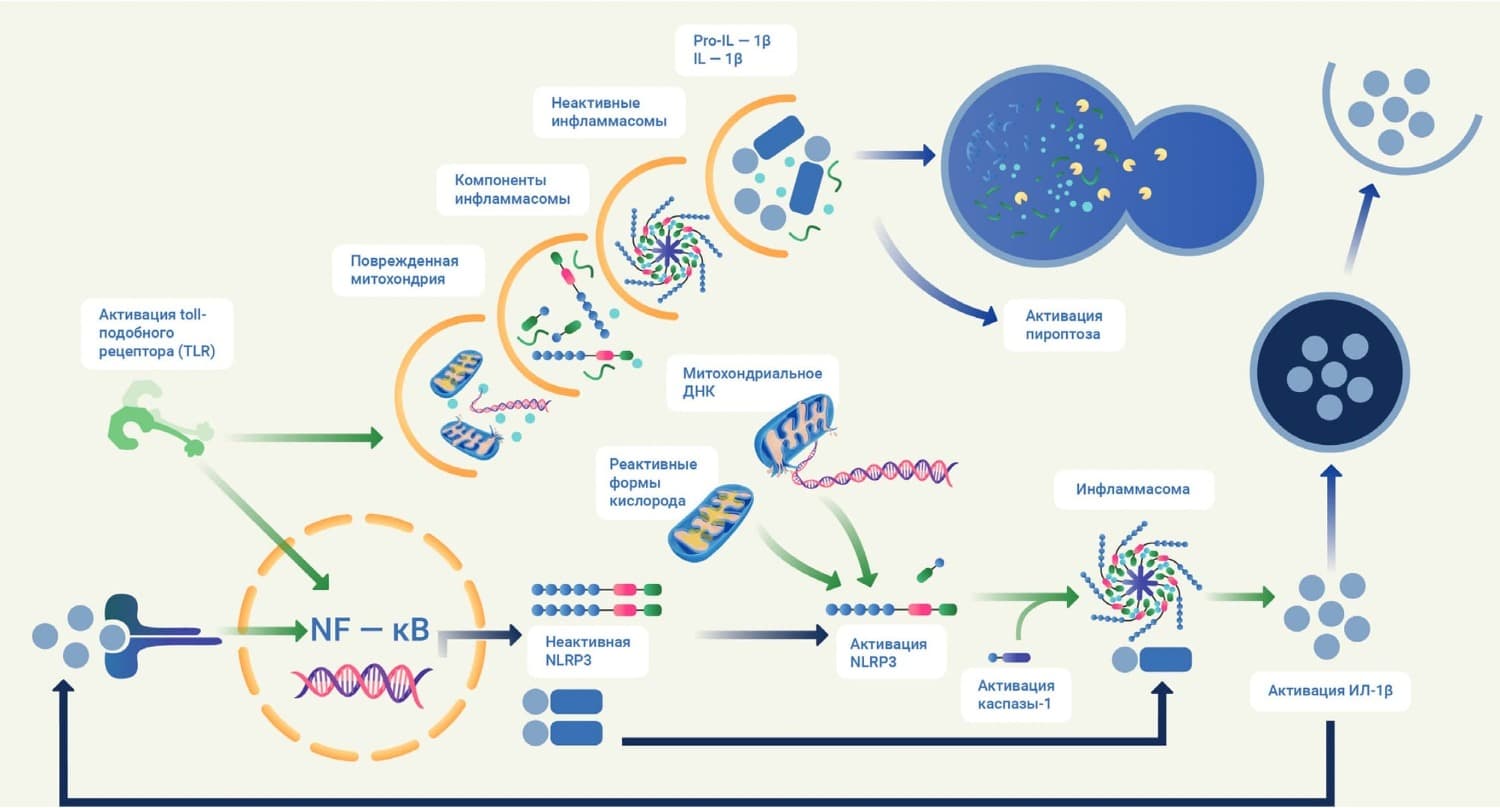
Более сложным представляется процесс образования инфламмасомы. Ряд клеток микроглии и астроцитов несут на своей поверхности специализированные "паттернраспознающие рецепторы" (pattern-recognizing receptors – PRR). К семейству PRR принадлежат в том числе особые рецепторы – NLR – nucleotide-binding leucine-rich repeat containing (связывающие нуклеотид и содержащие обогащенные лейцином повторы). Основной функцией NLR является распознавание микробных белков или молекулярных структур, образующихся при повреждении компонентов цитоскелета. Термином "инфламмасома" обозначают макромолекулярные образования, формирующиеся после активации различных видов NLR (рис. 1). Их именуют по типу белка NLR, входящего в их состав (например, NLRP1, NLRP3, NLRC4, NLRC5 и др.). Наиболее изучена NLRP3 инфламмасома, ответственная за развитие нейровоспаления при ряде нейродегенеративных и сосудистых заболеваний головного мозга [3]. Для активации "сборки" NLRP3 инфламмасомы необходимы два сигнала. В качестве первого сигнала ("инициирующего") выступает увеличение концентрации в мозговой ткани ряда известных цитокинов: ФНО-α, ИЛ-1α и ИЛ-1b, лигандов toll-подобного рецептора (TLR) и др., что наблюдается, например, при менингоэнцефалите, черепно-мозговой травме, инсульте, рассеянном склерозе. Эти молекулы индуцируют активацию сигнального пути через NF-kB – универсальный фактор транскрипции, контролирующий экспрессию генов иммунного ответа, апоптоза, а также клеточного цикла. В неактивном состоянии NF-kB находится в цитоплазме и образует мультибелковый комплекс с ингибиторной субъединицей – IkB (inhibitor of kB). При стимуляции внешними раздражителями происходит активация ряда киназ IkB, которые объединяются в единый комплекс – IKK (IkB kinase complex). Активированный комплекс IKK высвобождает NF-kB, который затем мигрирует в ядро клетки, взаимодействует с kB в промоторной зоне различных генов воспалительного ответа и активирует их транскрипцию [4]. Среди прочих усиливается экспрессия NLRP3. Этот процесс получил название "priming" инфламмасомы (от англ. "вставление запала"). Второй сигнал обеспечивают внеклеточные молекулы АТФ, порообразующие токсины, а также кристаллы различных веществ (например, холестерина). Они вызывают олигомеризацию NLRP3 и молекулы ASC (apoptosis associated speck-like protein containing a caspase recruitment domain – белка-адаптера с доменом активации каспазы), что в итоге завершает процесс образования NLRP3 инфламмасомы [5]. Внутри ее аутопротеолиз прокаспазы-1 приводит к образованию активной каспазы-1, которая, в свою очередь, запускает программу пироптоза – особой формы гибели клетки в очаге воспаления.
Для пироптоза характерны быстрое разрушение плазматической мембраны, фрагментация ДНК и выделение флогогенного содержимого цитозоля клетки во внешнюю среду. По своим морфологическим признакам и механизмам развития пироптоз резко отличается от апоптоза, некроза и других форм гибели клетки. Он наблюдается как в клетках глии, так и в нейронах [6]. Таким образом, бесконтрольная или персистирующая активация инфламмасом представляет собой важный механизм нейровоспаления, возникающего при ишемическом поражении головного мозга в случае инсульта или ХИМ.
Современная стратегия лечения пациентов с ХИМ заключается в воздействии на модифицируемые факторы риска развития цереброваскулярной патологии (отказ от курения, снижение массы тела, увеличение двигательной активности и т.д.) и поиске нейропротекторов, позволяющих активизировать церебральный кровоток и/или метаболические процессы в головном мозге, повысить толерантность мозговой ткани к гипоксии, усилить нейропластические изменения в нейрональных центрах, активно подавить нейровоспаление.
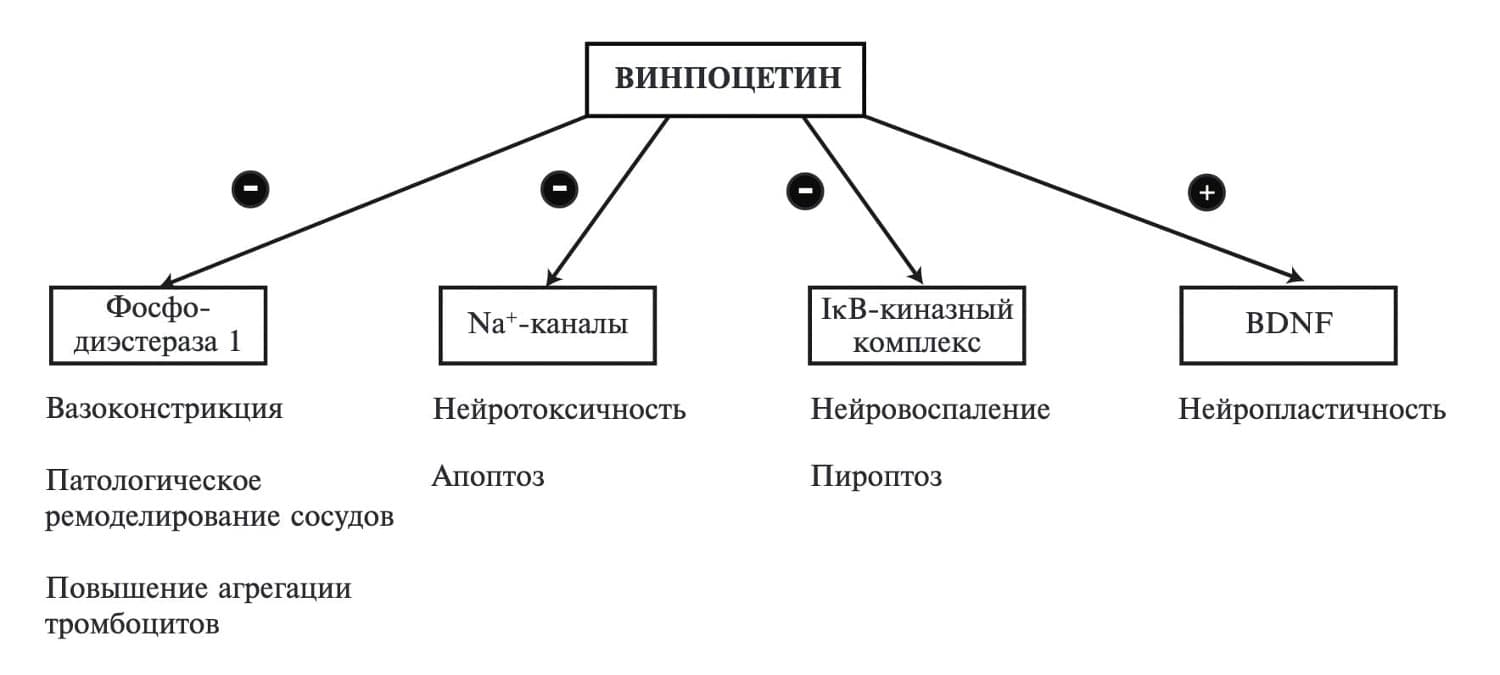
Среди нейропротекторов, представленных на фармацевтическом рынке, особое место занимает Кавинтон (винпоцетин). Согласно традиционному представлению, основной механизм действия винпоцетина связан с ингибированием фосфодиэстеразы (фермента, регулирующего содержание циклических нуклеотидов в тканях организма человека) и потенциалзависимых Na + -каналов, что позволяет ему непосредственно действовать на глутаматные рецепторы, ингибировать перекисное окисление липидов и тормозить агрегацию тромбоцитов [7,8]. Препарат, взаимодействуя с мембранами эритроцитов, увеличивает их деформируемость и в дозе 10 мг превосходит по эффективности ницерголин в дозе 20 мг и пентоксифиллин в дозе 300 мг [9]. Винпоцетин вызывает "управляемую" вазодилатацию спазмированных сосудов, действуя на артерии головного мозга как с повышенным, так и пониженным тонусом, восстанавливая способность к ауторегуляции церебрального кровообращения и предотвращая развитие вазоконстрикторных реакций, а также феномена "no-reflow" [10]. Применение винпоцетина значительно замедляло утолщение стенки сосудов и образование неоинтимы в сонных артериях мышей после их повреждения лигированием, а также значимо подавляло спонтанное ремоделирования эксплантатов подкожной вены человека в модели ex vivo [11]. У крыс с экспериментально индуцированным сахарным диабетом использование винпоцетина позволяло предотвратить гиперплазию неоинтимы сонных артерий после их повреждения методом балонной дилатации [12]. Ингибирующее действие винпоцетина на рост гладкомышечных клеток и ремоделирование сосудов, повидимому, связано со специфическим подавлением активности фосфодиэстеразы 1А или фосфодиэстеразы 1С [13].
Анализ результатов исследований последних лет позволил значительно расширить горизонт представлений о механизмах саногенетического действия винпоцетина, в том числе за счет его влияния на нейропластичность. Так, в ряде работ было показано, что препарат препятствует нейрональной гибели в области гиппокампа, стимулирует норадренергическую систему восходящей ретикулярной формации и увеличивает рост дендритных шипиков [14,15]. Кроме того, винпоцетин индуцирует экспрессию мозгового нейротрофического фактора – BDNF (brain-derived neurotrophic factor). Эти данные послужили убедительным доказательством терапевтической эффективности препарата за счет модуляции нейропластичности головного мозга (изменения активности нервных клеток и образования новых нейрональных связей и ассоциаций) [16,17].
И, наконец, еще одной мишенью терапевтического действия винпоцетина является нейровоспаление. Эффект винпоцетина в этом отношении реализуется через ингибирование NF-kB-зависимого воспалительного ответа. Препарат прямо взаимодействует с IKK, что было доказано в исследованиях in vitro, проведенных на культуре эндотелиоцитов, гладкомышечных клеток сосудистой стенки, макрофагов и моноцитов, [18], нейтрофилов [19], эпителиальных клеток [20], клеток микроглии головного мозга [21], а также плазмоцитоидных дендритных клеток [22]. Винпоцетин ослабляет IKK-опосредованное фосфорилирование IkB, что повышает ее стабильность и приводит к связыванию IkB с NF-kB с последующем подавлением экспрессии NF-kB-зависимых провоспалительных молекул, в том числе препятствует формированию NLRP3 инфламмасомы [20].
Следует отметить, что влияние винпоцетина на торможение NF-kB-зависимой транскрипционной активности опосредовано за счет отдельного механизма, независимого от подавления фосфодиэстеразы и потенциалзависимых Na+-каналов. Это было доказано в экспериментальном исследовании, предполагавшем последовательное применение IC86340 и тетродотоксина – селективных ингибиторов фосфодиэстеразы и Na+-каналов, соответственно, которые, как оказалось, не оказывают влияние на NF-kB-опосредованную транскрипционную активность [18]. Противовоспалительные эффекты винпоцетина также были установлены в ходе различных исследований in vivo. В модели церебральной ишемии-реперфузии у крыс было обнаружено, что уровни NF-kB и ФНО-α связаны с изменениями степени отека головного мозга и объема зоны церебрального инфаркта [23]. Авторы продемонстрировали ингибирование экспрессии NF-kB и ФНО-α, а также уменьшение воспалительной реакции после церебральной ишемии-реперфузии на фоне применения винпоцетина. Еще важнее, что противовоспалительный эффект винпоцетина был подтвержден в многоцентровом исследовании с участием 60 пациентов, перенесших острое нарушение мозгового кровообращения по ишемическому типу (рандомизированное клиническое исследование CAVIN) [24]. В группе пациентов, получавших винпоцетин, было установлено не только значительно лучшее восстановление неврологических функций, но и снижение активности NF-kB и экспрессии провоспалительных медиаторов. Кроме того, винпоцетин оказался эффективным и в других моделях воспалительных реакций у животных, таких как липополисахарид-индуцированная гипералгезия [19], средний отит у мышей [25] и острое повреждение почек [26].
Заключение
Воспалительные механизмы играют важную роль в развитии различных заболеваний нервной системы, в том числе цереброваскулярной патологии. Данное обстоятельство открывает новые перспективы в поиске эффективных нейропротекторов для совершенствования подходов к профилактике и лечению цереброваскулярных заболеваний. Винпоцетин является лекарственным препаратом с мультимодальным действием, направленным на различные патофизиологические мишени (рис. 2). Его терапевтические эффекты, включая сосудорасширяющий, антиоксидантный, противовоспалительный, антитромботический и стимуляцию нейропластичности, реализуются одновременно, вызывая синергетическое воздействие на головной мозг, что крайне актуально в лечении ХИМ как многофакторного цереброваскулярного заболевания. Молекулярные механизмы, лежащие в основе некоторых фармакологических эффектов винпоцетина, требуют дальнейшего изучения. Успешная разработка линий генетически модифицированных животных, включая knock-out мышей с избирательной инактивацией генов, кодирующих ряд изоформ фосфодиэстеразы (например, семейства PDE1), IKK, BDNF и натриевых каналов, будет способствовать уточнению механизмов действия препарата.
Используемые источники
- Поликарпов А.В., Александрова Г.А., Голубев Н.А. и др. Общая заболеваемость взрослого населения России в 2017 году. Часть 4. М.; 2018. 13 с. Режим доступа: https://www.rosminzdrav.ru/ministry/61/22/stranitsa-979/statisticheskie-i-informatsionnyematerialy/statisticheskiy-sbornik-2017-god.
- DiSabato DJ, Quan N, Godbout JP. Neuroinflammation: the devil is in the details. J Neurochem 2016;139 (Suppl 2):136-53.
- Davis BK, Wen H, Ting JP-Y. The Inflammasome NLRs in immunity, inflammation, and associated diseases. Ann Rev Immunol 2011;29:707-35.
- Rothwarf DM, Karin M. The NF-kappa B activation pathway: A paradigm in information transfer from membrane to nucleus. Sci STKE 1999;1999(5):RE1.
- Embry CA, Franchi L, Nunez G, Mitchell TC. Mechanism of impaired NLRP3 inflammasome priming by monophosphoryl lipid A. Sci Signal 2011;4:ra28.
- Bergsbaken T, Fink SL, Cookson BT. Pyroptosis: host cell death and inflammation. Nat Rev Microbiol 2009;7:99-109.
- Nicholson CD. Pharmacology of nootropics and metabolically active compounds in relation to their use in dementia. Psychopharmacology (Berlin) 1990;101:147-59.
- Kuzuya F. Effects of vinpocetine on platelet aggregability and erythrocyte deformability. Ther Hung 1985;33(1):22-34.
- Hayakawa M. Comparative efficacy of vinpocetine, pentoxifylline and nicergoline on red blood cell deformability. Arzneimittelforschung 1992;42:108-10.
- King GA. Protective effects of vinpocetine and structurally related drugs on the lethal consequences of hypoxia in mice. Arch Int Pharmacodyn 1987;286:299–307.
- Cai Y, Knight WE, Guo S, et al. Vinpocetine suppresses pathological vascular remodeling by inhibiting vascular smooth muscle cell proliferation and migration. J. Pharmacol Exp Ther 2012;343:479–88.
- Wang K, Wen L, Peng W, et al. Vinpocetine attenuates neointimal hyperplasia in diabetic rat carotid arteries after balloon injury. PLoS One 2014;9:e96894.
- Nagel DJ, Aizawa T, Jeon K-I, et al. Role of nuclear Ca2+/calmodulin-stimulated phosphodiesterase 1A in vascular smooth muscle cell growth and survival. Circ Res 2006;98:777–84.
- Gulyás B, Tóth M, Schain M, et al. Evolution of microglial activation in ischaemic core and peri-infarct regions after stroke: A PET study with the TSPO molecular imaging biomarker [11C] vinpocetine. J Neurol Sci 2012;320:110-17.
- Скоромец А.А, Алиев К.Т., Лалаян Т.В. и др. Когнитивные функции и лечение их нарушений при хронической недостаточности кровообращения в вертебрально-базилярной системе у пожилых. Журнал неврологии и психиатрии им. С.С. Корсакова 2013;113(4):18-24 [Skoromets AA, Aliev KT, Lala - yan TV, et al. Cognitive functions and treatment of their impairment in elderly patients with the vertebrobasilar issufficiensy Zh Nevrol Psikhiatr Im SS Korsakova 2013;113(4):18-24 (In Russ.)].
- Живолупов С.А., Самарцев И.Н., Яковлев Е.В. и др. Эффективность винпоцетина (Кавинтона Комфорте) в лечении головокружения у пациентов с дисциркуляторной энцефалопатией и его влияние на концентрацию нейротрофического фактора мозга (BDNF) в плазме. Клин фармакол тер 2016;1:48-53 [Zhivolupov SA, Samartsev IN, Yakovlev EV, et al. The effectiveness of Vinpocetine (Cavinton Comfort) in the treatment of dizziness in patients with dyscirculatory encephalopathy and its effect on the concentration of brain neurotrophic factor (BDNF) in plasma. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2016;1:48-53 (In Russ.)].
- Самарцев И.Н., Живолупов С.А., Бутакова Ю.С. и др. Эффективность длительного приема винпоцетина при лечении головокружения и ассоциированных статодинамических нарушений у пациентов с хронической недостаточностью мозгового кровообращения (исследование ЭДЕЛЬВЕЙС). Неврология, нейропсихиатрия, психосоматика 2019;11(1):36–47 [Samartsev IN, Zhivolupov SA, Butakova YS, et al. Efficiency of long-term vinpocetine administration in the treatment of dizziness and associated statodynamic disorders in patients with chronic cerebrovascular insufficiency (EDELWEISS study). Neurology Neuropsychiatry Psychosomatics 2019;11(1):36-47 (In Russ.)].
- Jeon K-I, Xu X, Aizawa T, et al. Vinpocetine inhibits NF-kappaB-dependent inflammation via an IKK-dependent but PDE-independent mechanism. Proc Natl Acad Sci USA 2010;107,9795–800.
- Ruiz-Miyazawa KW, Pinho-Ribeiro FA, Zarpelon AC, et al. Vinpocetine reduces lipopolysaccharide-induced inflammatory pain and neutrophil recruitment in mice by targeting oxidative stress, cytokines and NF-kappaB. Chem-Biol Interact 2015;237:9–17.
- Liu RT, Wang A, To E, et al. Vinpocetine inhibits amyloid-beta induced activation of NF-kappaB, NLRP3 inflammasome and cytokine production in retinal pigment epithelial cells. Exp Eye Res 2014;127:49–58.
- Zhao YY, Yu JZ, Li QY, et al. TSPO-specific ligand vinpocetine exerts a neuroprotective effect by suppressing microglial inflammation. Neuron Glia Biol 2011;7:187–97.
- Feng X, Wang Y, Hao Y, et al. Vinpocetine inhibited the CpG oligodeoxynucleotide-induced immune response in plasmacytoid dendritic cells. Immunol Investig 2017;46:263–73.
- Wang H, Zhang K, Zhao L, et al. Anti-inflammatory effects of vinpocetine on the functional expression of nuclear factor-kappa B and tumor necrosis factor-alpha in a rat model of cerebral ischemia-reperfusion injury. Neurosci Lett 2014;566:247–51.
- Zhang W, Huang Y, Li Y, et al. Efficacy and safety of vinpocetine as part of treatment for acute cerebral infarction: a randomized, open-label, controlled, multicenter CAVIN (Chinese Assessment for Vinpocetine in Neurology) trial. Clin Drug Investig 2016;36:697–704.
- Lee JY, Komatsu K, Lee BC, et al. Vinpocetine inhibits Streptococcus pneumoniae-induced upregulation of mucin MUC5AC expression via induction of MKP1 phosphatase in the pathogenesis of otitis media. J Immunol 2015;194:5990–8.
- Fattori V, Borghi SM, Guazelli CFS, et al. Vinpocetine reduces diclofenacinduced acute kidney injury through inhibition of oxidative stress, apoptosis, cytokine production, and NF-kappaB activation in mice. Pharmacol Res 2017;120:10–22.
