Поражение сердца при болезни Фабри: особенности течения и диагностическое значение магнитно-резонансной томографии и speckle-tracking эхокардиографии
Изучение частоты и течения поражения сердца при болезни Фабри (БФ) и диагностического значения магнитно-резонансной томографии (МРТ) с контрастированием гадолинием и speckle-tracking эхокардиографии.
В исследование были включены 186 взрослых пациентов с БФ, в том числе 114 мужчин (медиана возраста – 38,0 лет). 116 больным была проведена МРТ сердца с контрастированием гадолинием на томографах Магнетом Аванто (Siemens Healthcare) или Оптима 450 (GE Healthcare), а 35 – speckle-traсking эхокардиография на аппаратах Vivid 7, Vivid E9 или E95 (GE Healthcare). Критерием гипертрофии миокарда было увеличение толщины стенки левого желудочка (ЛЖ) и/или межжелудочковой перегородки ≥12 мм.
При МРТ сердца асимметричная или симметричная гипертрофия ЛЖ была выявлена у 58 (50,0%) из 116 пациентов. У мужчин она развивалась чаще и примерно на 10 лет раньше, чем у женщин. У 22 (37,9%) из 58 пациентов с гипертрофией миокарда определялись очаги фиброза. 14 (63,6%) из 22 больных с выраженной гипертрофией ЛЖ находились на лечении гемодиализом. При speckle-tracking эхокардиографии у пациентов с гипертрофией миокарда выявлено снижение глобальной продольной деформации ЛЖ (GLS) и ухудшение показателей его работы несмотря на отсутствие снижения фракции выброса ЛЖ. Основным проявлением гипертрофии ЛЖ при БФ были аритмии, прежде всего фибрилляция предсердий (8,7% и 5,6% у мужчин и женщин, соответственно). У 16 (8,7%) из 186 больных поражение сердца было ведущим в клинической картине заболевания (боли в сердце, нарушение ритма и/или изменения на ЭКГ), в связи с чем они обращались к кардиологу, а при обследовании обсуждался диагноз гипертрофической кардиомиопатии. Умерли 18 (9,7%) из 186 больных (медиана возраста на момент смерти – 44,5 лет), в том числе 17 – от сердечно-сосудистых причин (преимущественно внезапно). Все умершие пациенты были мужчинами, а 14 из них находились на лечении гемодиализом.
Поражение сердца наблюдалось примерно у половины взрослых пациентов с БФ и характеризовалось развитием симметричной или асимметричной гипертрофии ЛЖ, часто сочетавшейся с фиброзом миокарда. Две трети больных с выраженной гипертрофией ЛЖ нуждались в заместительной почечной терапии, которая сопровождалась также значительным увеличением смертности от сердечных причин.
Болезнь Фабри (БФ) – это редкое наследственное заболевание, которое относится к лизосомным болезням накопления и развивается в результате мутаций гена GLA, расположенного на Х-хромосоме и кодирующего лизосомный фермент α-галактозидазу А [1,2]. Дефицит этого фермента, разрушающего гликосфинголипиды в лизосомах, приводит к их накоплению в клетках и прогрессирующей дисфункции внутренних органов. Гликосфинголипиды откладываются во всех клетках сердца, в том числе кардиомиоцитах, эндотелиальных и гладкомышечных клетках сосудов, клетках эндокарда и проводящей ткани, фибробластах клапанов [3]. Накопление гликосфинголипидов в кардиомиоцитах вызывает прогрессирующую гипертрофию левого желудочка, которая является истинной, так как доля гликосфинголипидов составляет менее 3% от массы миокарда [4]. Важную роль в патогенезе кардиомиопатии при БФ, особенно на более ранних этапах, играет воспаление, развивающееся под действием гликосфинголипидов, которые выступают в роли аутоантигенов и индуцируют различные биохимические и функциональные изменения в клетках [5]. Гипертрофия миокарда при БФ часто сопровождается аритмиями и в конечном итоге приводит к развитию хронической сердечной недостаточности на фоне прогрессирующего фиброза миокарда [6].
При классическом варианте БФ первые симптомы, в том числе нейропатическая боль, ангиокератомы, сниженное потоотделение, желудочно-кишечные нарушения, появляются в детском или подростковом возрасте, однако поражение сердца и других органов, прежде всего почек и головного мозга, формируется в возрасте 20-30 лет и старше [7]. Выделяют также поздний вариант заболевания, при котором ранние симптомы отсутствуют и отмечается позднее начало, обычно в возрасте 40-50 лет, с изолированным или преимущественным поражением одного органа, прежде всего сердца. Поздний вариант болезни Фабри ассоциируется с определенными мутациями гена GLA, например, IVS4+919G>A, которая часто встречается у жителей Тайваня [8]. В наших предыдущих публикациях были рассмотрены различные проявления и исходы БФ [912].
Целью настоящего исследования было изучение частоты и особенностей течения поражения сердца при БФ и диагностического значения магнитно-резонансной томографии (МРТ) с контрастированием гадолинием и speckle-tracking эхокардиографии.
Материал и методы
В исследование включали взрослых пациентов (18 лет и старше) с БФ, обследованных в клинике им. Е.М. Тареева. Критериями диагноза БФ служили наличие патогенной мутации гена GLA в сочетании со снижением активности αгалактозидазы А (у мужчин), повышением содержания глоботриаозилсфингозина (Lyso-GL3) в высушенных пятнах крови и/или по крайней мере одним типичным проявлением заболевания (нейропатическая боль, ангиокератомы и вихревидная кератопаия) [13]. У родственников пробанда диагноз устанавливали на основании наличия той же патогенной мутации гена GLA.
Молекулярно-генетическое исследование и определение содержания α-галактозидазы А и Lyso-GL3 проводили в лабораториях Centogene AG (Росток, Германия), ARCHIMED Life Science GmbH (Вена, Австрия), Медикогенетического научного центра имени академика Н.П. Бочкова и/или Национального медицинского исследовательского Центра Здоровья Детей. Активность α-галактозидазы А и уровень Lyso-GL3 в высушенных пятнах крови измеряли методом тандемной масс-спектрометрии. Нормальным считали содержание Lyso-GL3 менее 2,0 нг/мл. При молекулярно-генетическом исследовании изучали все кодирующие экзоны (1-7) с прилегающими интронными областями гена GLA. Минорные варианты генома с частотой встречаемости менее 0,5% в соответствии с информационной базой gnomAD19, в том числе нуклеотидные варианты, не описанные ранее, подвергались биоинформатическому анализу в программе Alamut Visual (Interactive Biosoftware, Франция) и валидировались при помощи секвенирования по Сэнгеру. Последовательности нуклеотидов сравнивали с референсной базой данных GenBank Accession20 с использованием программы Geneious, версия R10 (Biomatters, Новая Зеландия).
У всех больных определяли суточную альбуминурию турбидиметрическим методом, протеинурию стандартным методом, сывороточный уровень креатинина и рассчитывали скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI. Экскрецию альбумина/белка с мочой и функцию почек оценивали на основании рекомендаций KDIGO [14]. Очаговые изменения в белом вещества головного мозга и признаки перенесенного инсульта определяли при МРТ головного мозга (Siemens Magnetom Skyra 3 Тесла).
МРТ сердца выполняли на магнитно-резонансных томорафах с напряженностью поля 1,5 Тл Магнетом Аванто (Siemens Healthcare, Germany) или Оптима 450 (GE Healthcare, USA). Для выявления отсроченного контрастирования миокарда использовали контрастный гадолинийсодержащий препарат, который вводили внутривенно в дозе 0,15 ммоль/кг. Индексированные значения конечных систолического и диастолического объемов левого желудочка (ЛЖ), а также массу миокарда (ММ) ЛЖ определяли полуавтоматически с помощью программного обеспечения CMR 42 путем обработки срезов по короткой оси ЛЖ. Критерием гипертрофии миокарда было увеличение толщины стенки ЛЖ и/или межжелудочковой перегородки ≥12 мм. Выделяли легкую (12-13 мм), умеренную (14-15 мм) и выраженную (>15 мм) гипертрофию миокарда. При диагностике гипертрофии левого желудочка учитывали также индекс массы миокарда (верхняя граница нормы 85 г/м2 у мужчин и 81 г/м2 у женщин) [15].
Эхокардиографию проводили на экспертных аппаратах Vivid 7, Vivid E9 или E95 (GE Healthcare) по стандартному протоколу с анализом изображений при помощи программного обеспечения EchoPAC (GE Healthcare, США). Помимо стандартных показателей с помощью speckletracking эхокардиографии определяли глобальную продольную деформацию ЛЖ (GLS, %) и рассчитывали показатели его работы в автоматическом режиме: GWI (Global Work Index, мм рт. ст. %) – индекс глобальной работы, определяемый как объем миокардиальной работы, выполняемой левым желудочком в систолу и равный площади под кривой давление-деформация, GCW (Global Constructive Work, мм рт. ст. %) – глобальная конструктивная работа, обеспечивающая насосную функцию сердца и представляющая собой сумму положительной работы в систолу и отрицательной работы в диастолу, GWW (Global Wasted Work, мм рт. ст. %) – показатель работы впустую, который рассчитывается как сумма отрицательной работы во время систолы и положительной работы в диастолу, GWE (Global Work Efficiency, %) – эффективность глобальной работы, определяемая по формуле GCW/(GCW+GWW).
Статистический анализ проводили с использованием программы IBM SPSS Statistics 22 (IBM Corporation, США). Нормальность распределения определяли с помощью критерия Шапиро-Уилка. Данные для количественных показателей с распределением, отличавшимся от нормального, приведены в виде медианы и межквартильного размаха (Me (IQR)). Медианы количественных показателей сравнивали с помощью t-критерия Стьюдента (при отсутствии значимых отклонений от нормального распределения) или Uкритерия Манна-Уитни (при отклонении распределения от нормального), а качественные показатели – с помощью точного критерия Фишера. Анализ выживаемости проводили с использованием метода Каплана-Мейера. Различия считали достоверными при величине p<0,05. Все результаты приведены с двусторонним уровнем значимости.
Результаты
Характеристика пациентов. В исследование были включены 186 взрослых пациентов с БФ, в том числе 114 мужчин и 72 женщины (табл. 1). Медиана возраста составила 38,0 лет (29,0;49,0). Среди обследованных был 101 (54,3%) пробанд, в то время как в остальных случаях диагноз был установлен в процессе семейного скрининга, т.е. обследования родственников индексных пациентов. У всех больных были выявлены патогенные мутации гена GLA, в основном миссенс мутации. У большинства пациентов наблюдался классический вариант БФ, характеризующийся появлением типичных симптомов, таких как нейропатическая боль, ангиокератомы и/или сниженное потоотделение, в детском или подростковом возрасте. У 159 (85,5%) больных наблюдалось поражение почек, проявлявшееся альбуминурией/протеинурией и/или снижением расчетной СКФ <60 мл/мин/1,73 м2 , а у 100 (53,8%) – поражение головного мозга в виде бессимптомных очаговых изменений белого вещества головного мозга, определявшихся при МРТ, или инсульта, в том числе повторного. 49 (26,3%) больных получали заместительную почечную терапию (программный гемодиализ у 45 пациентов, трансплантация почки была выполнена 4 больным).
| Показатели | Все (n=186) | Мужчины (n=114) | Женщины (n=72) | p |
|---|---|---|---|---|
| Примечание: р – статистическая значимость различий показателей между мужчинами и женщинами. Альбуминурия – эскреция альбумина с мочой >30 мг/сут | ||||
| Возраст на момент обследования, лет | 38,0 (29,0;49,0) | 36,0 (29,0;46,0) | 42,5 (30,0;56,5) | <0,01 |
| Снижение активности α-галактозидазы А, n (%) | 120/153 (78,4) | 96/103 (93,2) | 24/50 (48,0) | <0,01 |
| Типы мутаций гена GLA, n (%) | ||||
| миссенс | 112 (60,2) | 71 (62,3) | 41 (56,9) | 0,28 |
| нонсенс | 31 (16,7) | 15 (13,2) | 16 (22,2) | 0,79 |
| другие | 43 (23,1) | 28 (24,6) | 15 (20,8) | 0,34 |
| Медиана содержания Lyso-GL3, нг/мл | 15,2 (6,8;80,5) | 70,38 (25,5;98,0) | 7,41 (4,1;10,9) | <0,01 |
| Ранние симптомы БФ, n (%) | ||||
| нейропатическая боль | 131 (70,4) | 88 (77,2) | 43 (59,7) | 0,01 |
| ангиокератомы | 66 (35,5) | 57 (50,0) | 9 (12,5) | <0,01 |
| гипо-/ангидроз | 99 (53,2) | 75 (65,8) | 24 (33,3) | <0,01 |
| желудочно-кишечные нарушения | 52 (27,9) | 39 (34,2) | 13 (18,1) | 0,01 |
| вихревидная кератопатия | 108/162 (66,7) | 56/92 (60,9) | 52/70 (74,3) | 0,05 |
| Поражение внутренних органов, n (%) | ||||
| альбуминурия/протеинурия | 135 (72,6) | 78 (68,4) | 57 (79,2) | 0,08 |
| СКФ <60 мл/мин/1,73 м2 | 69 (37,1) | 57 (50,0) | 12 (16,7) | <0,01 |
| заместительная почечная терапия | 49 (26,3) | 48 (42,1) | 1 (5,0) | <0,01 |
| очаговые изменения на МРТ головного мозга | 90/174 (51,7) | 58/105 (55,2) | 32/69 (46,4) | 0,16 |
| инсульт в анамнезе | 36 (19,4) | 27 (23,7) | 9 (12,5) | 0,04 |
| катаракта Фабри | 31 (16,7) | 29/92 (31,5) | 2/70 (2,9) | <0,01 |
| нейросенсорная тугоухость | 34 (18,3) | 29 (25,4) | 5 (6,9) | <0,01 |
Результаты МРТ. МРТ сердца была проведена 116 пациентам с болезнью Фабри, включая 67 мужчин и 49 женщин. Медиана возраста пациентов составила 34,5 лет (27,5;45,0). Мужчины были несколько моложе женщин, однако разница медианы возраста у пациентов разного пола была статистически незначимой: 34,5 (27,5;45,0) и 37,0 (29,0;50,0) лет, соответственно (р=0,06). Медиана индекса ММЛЖ у мужчин достоверно превышала таковую у женщин: 78,0 и 61,0 г/м2, соответственно (р<0,01). Как у мужчин, так и женщин выявлена прямая корреляция между индексом ММЛЖ и возрастом (r=0,492, p=0,015 и r=0,522, p=0,001, соответственно).
Гипертрофия левого желудочка была диагностирована у 58 (50,0%) из 116 пациентов, в том числе у 41 (61,2%) из 67 мужчин и 17 (34,7%) из 49 женщин. Разница частоты гипертрофии миокарда между мужчинами и женщинами не достигла статистической значимости (p=0,18), однако кумулятивная частота гипертрофии левого желудочка в зависимости от возраста, рассчитанная с помощью метода КапланаМейера, у мужчин была достоверно выше, чем у женщин (p<0,01) (рис. 1). Кроме того, гипертрофия миокарда у мужчин развивалась примерно на 10 лет раньше, чем у женщин.
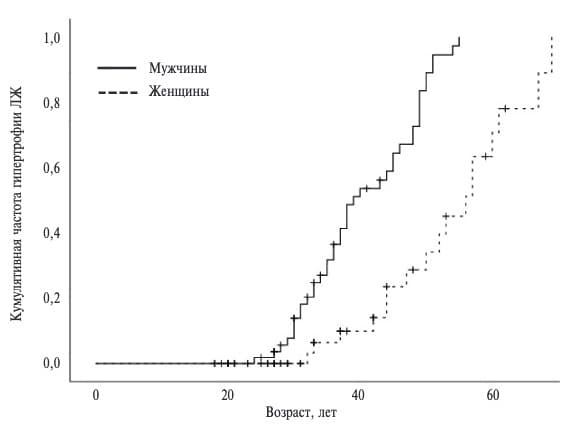
Пациенты, у которых была выявлена гипертрофия миокарда, были старше больных с нормальной ММЛЖ (43,5 и 28,0 лет, соответственно) (табл. 2). Кроме того, в первой группе была значительно больше доля мужчин (70,7% и 44,8%, соответственно). Легкая гипертрофия миокарда ЛЖ определялась у 18 (31,0%) из 58 пациентов, умеренная – у 18 (31,0%) и выраженная – у 22 (37,9%). Четырнадцать (63,6%) из 22 пациентов с выраженной гипертрофией миокарда страдали терминальной стадией хронической болезни почек (ХБП) и получали лечение гемодиализом.
| Показатели | Гипертрофия ЛЖ | Фиброз миокарда | ||||
|---|---|---|---|---|---|---|
| Есть (n=58) | Нет (n=58) | p | Есть (n=25) | Нет (n=91) | p | |
| Примечание: ЛЖ – левый желудочек, ПЖ – правый желудочек, ЛП – левое предсердие. Приведены медианы и интерквартильный размах, если не указано иное | ||||||
| Мужчины, n (%) | 41 (70,7) | 26 (44,8) | <0,01 | 17 (68,0) | 50 (54,9) | 0,17 |
| Медиана возраста, лет | 43,5 (34,0;50,0) | 28,0 (25,0;36,0) | <0,01 | 48,0 (37,0;53,0) | 32,0 (27,0;42,0) | <0,01 |
| Индекс ММЛЖ, г/м2 | 98 (77,0;130,0) | 64,0 (57,0;71,0) | <0,01 | 120,0 (92,5;146,5) | 71 (61,0;81,0) | <0,01 |
| Очаги фиброза | 22 (37,9) | 3 (5,2) | <0,01 | – | – | – |
| Вклад массы папиллярных мышц, % | 6,4 (5,7;10,4) | 9,8 (6,7;11,1) | 0,09 | 6,1 (5,7;7,6) | 9,6 (6,2;12,1) | 0,89 |
| Толщина стенки ЛЖ, мм | 10,0 (9,0;13,0) | 7,0 (6,0;8,0) | <0,01 | 11,0 (9,0;13,0) | 8,0 (7,0;10,0) | <0,01 |
| Толщина межжелудочковой перегородки, мм | 14,0 (12,0;17,0) | 9,0 (8,0;10,0) | <0,01 | 15,0 (12,0;18,0) | 10,0 (9,0;13,0) | <0,01 |
| Конечный диастолический размер ЛЖ, см | 5,1 (4,8;5,6) | 5,0 (4,6;5,3) | 0,04 | 5,1 (5,0;5,6) | 5,1 (4,6;5,4) | 0,17 |
| Конечный систолический размер ЛЖ, см | 3,3 (3,0;3,8) | 3,2 (2,9;3,5) | 0,34 | 3,4 (2,9;3,8) | 3,2 (2,9;3,6) | 0,54 |
| Индекс конечного диастолического объема ЛЖ, мл/м2 | 74,0 (61,0;89,3) | 74,0 (67,0;84,5) | 0,09 | 73,0 (60,5;92,0) | 75,0 (63,9;85,0) | 0,93 |
| Индекс конечного систолического объема ЛЖ, мл/м2 | 25,5 (17,0;34,0) | 26,5 (20,0;32,0) | 0,84 | 22,0 (17,0;29,0) | 26,4 (20,0;32,0) | 0,27 |
| Фракция выброса ЛЖ, % | 67,0 (61,0;72,0) | 67,0 (62,0;71,0) | 0,97 | 67,0 (63,0;72,0) | 67,0 (62,0;71,0) | 0,74 |
| Конечный диастолический размер ПЖ, см | 4,0 (3,7;4,5) | 4,0 (3,5;4,5) | 0,33 | 4,2 (3,7;4,8) | 4,0 (3,6;4,4) | 0,35 |
| Конечный систолический размер ПЖ, см | 3,0 (2,7;3,5) | 3,0 (2,5;3,4) | 0,99 | 3,2 (2,6;3,5) | 3,0 (2,6;3,4) | 0,49 |
| Размер левого предсердия, см | 4,0 (3,6;4,4) | 3,7 (3,3;4,0) | <0,01 | 4,0 (3,7;4,3) | 3,8 (3,3;4,1) | 0,06 |
У 26 (44,8%) из 58 больных диагностирована симметричная гипертрофия ЛЖ, у остальных больных отмечалось асимметричное утолщение межжелудочковой перегородки (отношение толщины межжелудочковой перегородки и стенки левого желудочка ≥1,3). У 1 больного с выраженной асимметричной гипертрофией межжелудочковой перегородки имелся градиент давления в выносящем тракте ЛЖ, что потребовало оперативного вмешательства. Гипертрофия ЛЖ сопровождалось увеличением размера левого предсердий, в то время как размеры других камер сердца и фракция выброса ЛЖ достоверно не отличались между двумя группами. Снижение фракции выброса ЛЖ менее 50% было выявлено только у 2 пациентов.
Очаги фиброза при МРТ с контрастированием гадолинием определялись у 25 (21,5%) из 116 больных, в том числе у 22 (37,9%) из 58 пациентов с гипертрофией миокарда и у 3 (5,2%) из 58 пациентов без гипертрофии ЛЖ. Среди 25 пациентов с фиброзом преобладали мужчины (68,0%), хотя частота позднего накопления гадолиния достоверно не отличалась у мужчин и женщин (21,4% и 16,3%, соответственно). Чаще всего очаги фиброза определялись в заднебоковых и переднебоковых сегментах базальной и средней части ЛЖ. Медиана индекса ММЛЖ у пациентов с участками интрамиокардиального фиброза достоверно превышала таковую у больных без фиброза (120,0 и 71 г/м2, соответственно; p<0,01) (табл. 2). Сходные результаты были получены при сравнении толщины стенки ЛЖ и межжелудочковой перегородки. В то же время развитие интрамиокардиального фиброза не сопровождалось изменениями размеров ЛЖ и левого предсердия и фракции выброса ЛЖ.
У 30 (25,9%) из 116 пациентов была выявлена недостаточность митрального (у 24), аортального (у 6) и/или трикуспидального (12) клапанов. У 27 (90,0%) из 30 больных определялась недостаточность 1-2 степени и только у 3 пациентов – 3 степени. Изменений клапанов легочной артерии выявлено не было.
Speckle-tracking эхокардиография. Эхокардиография с определением миокардиальной работы была выполнена у 35 пациентов с БФ, в том числе 20 мужчин и 15 женщин. Медиана возраста пациентов на момент обследования составила 35,5 (26,0; 48,0) года. У 18 (51,4%) из них определясь гипертрофия ЛЖ, у 6 (17,1%) из 34 пациентов были выявлены очаги заместительного фиброза миокарда при МРТ сердца. Фракция выброса ЛЖ у всех пациентов была нормальной.
У мужчин медиана GLS была меньше, чем у женщин (13,5% и 18,0%, соответственно, p=0,02). Кроме того, у мужчин эффективность глобальной работы (GWE) была ниже, чем у женщин, а показатель работы впустую (GWW) – наоборот, выше. В то же время индекс глобальной работы (GWI) и показатель глобальной конструктивной работы (GCW) достоверно не отличались между группами пациентов, выделенными в зависимости от пола. У пациентов с гипертрофией миокарда отмечалось снижение GLS, GCW и GWE и повышение GWW по сравнению с таковыми у больных без гипертрофии ЛЖ, в то время как GWI был сопоставимым у пациентов двух групп (табл. 3).
| Показатели | Гипертрофия ЛЖ (n=18) | Без гипертрофии (n=17) | р |
|---|---|---|---|
| Примечание: GLS – глобальная продольная деформация ЛЖ, GWI – индекс глобальной работы, GCW – глобальная конструктивная работа, GWW – показатель работы впустую, GWE – эффективность глобальной работы. Приведены медианы и межквартильный размах, если не указано иное | |||
| Мужчины, n (%) | 12 (66,7) | 8 (47,1) | 0,2 |
| Медиана возраста, лет | 44,0 (36,0;50,0) | 27,0 (20,0;31,0) | <0,01 |
| Индекс ММЛЖ, г/м2 | 116,0 (93,0;185,0) | 74,9 (63,4;84,5) | <0,01 |
| Фиброз, n (%) | 6 (33,3) | 0 | 0,01 |
| GLS, % | 13,0 (9,0;15,0) | 18,0 (16,0;20,0) | <0,01 |
| GCW, мм рт. ст. % | 1617,5 (1289,0;1763,0) | 1865,0 (1757,0;2118,0) | 0,03 |
| GWW, мм рт. ст. % | 171,0 (100,0;285,0) | 84,0 (63,5;156,0) | <0,01 |
| GWI, мм рт. ст. % | 1342,0 (1011,0;1452,0) | 1445,0 (1257,0;1634,0) | 0,27 |
| GWE,% | 88,5 (85,0;91,0) | 94,0 (92,0;96,0) | <0,01 |
Клинические проявления поражения сердца и смертность. Хотя МРТ была выполнена только в части случаев, эхокардиографию проводили всем больным, включенным в исследование. Гипертрофия ЛЖ была выявлена при эхокардиографии и/или МРТ у 115 (61,8%) из 186 больных, включенных в исследование. У 83 (72,2%) больных она не сопровождалась какимилибо симптомами. У 20 больных отмечались клинически значимые нарушения ритма, в том числе фибрилляция предсердий (у 14). Частота фибрилляции предсердий была сопоставимой у мужчин и женщин (8,7% и 5,6% соответственно, p=0,3) Развитие сердечной недостаточности наблюдалось у 3 (1,6%) больных (у 1 пациента имелась фибрилляция предсердий).
У 16 пациентов, в том числе 4 мужчин и 12 женщин (медиана возраста – 58 лет [51,5;66,0]) больных поражение сердца было ведущим в клинической картине заболевания (боли в сердце, нарушение ритма и/или изменения на ЭКГ), в связи с чем они обращались к кардиологу, а при обследовании определялась гипертрофия миокарда и обсуждался диагноз гипертрофической кардиомиопатии. Медиана индекса ММЛЖ в этой группе составила 120,5 г/м2 (96,0;150,0), толщины задней стенки ЛЖ – 10,0 мм (9,0;13,5), межжелудочковой перегородки – 16,5 мм (13,5;19,0). У 8 (50,0%) больных была выполнена коронарография, при которой ни в одном случае не выявлено патологии коронарных сосудов. результаты. У 5 (31,3%) из 16 пациентов отсутствовали типичные проявления БФ (нейропатическая боль, ангиокератомы, сниженное потоотделение).
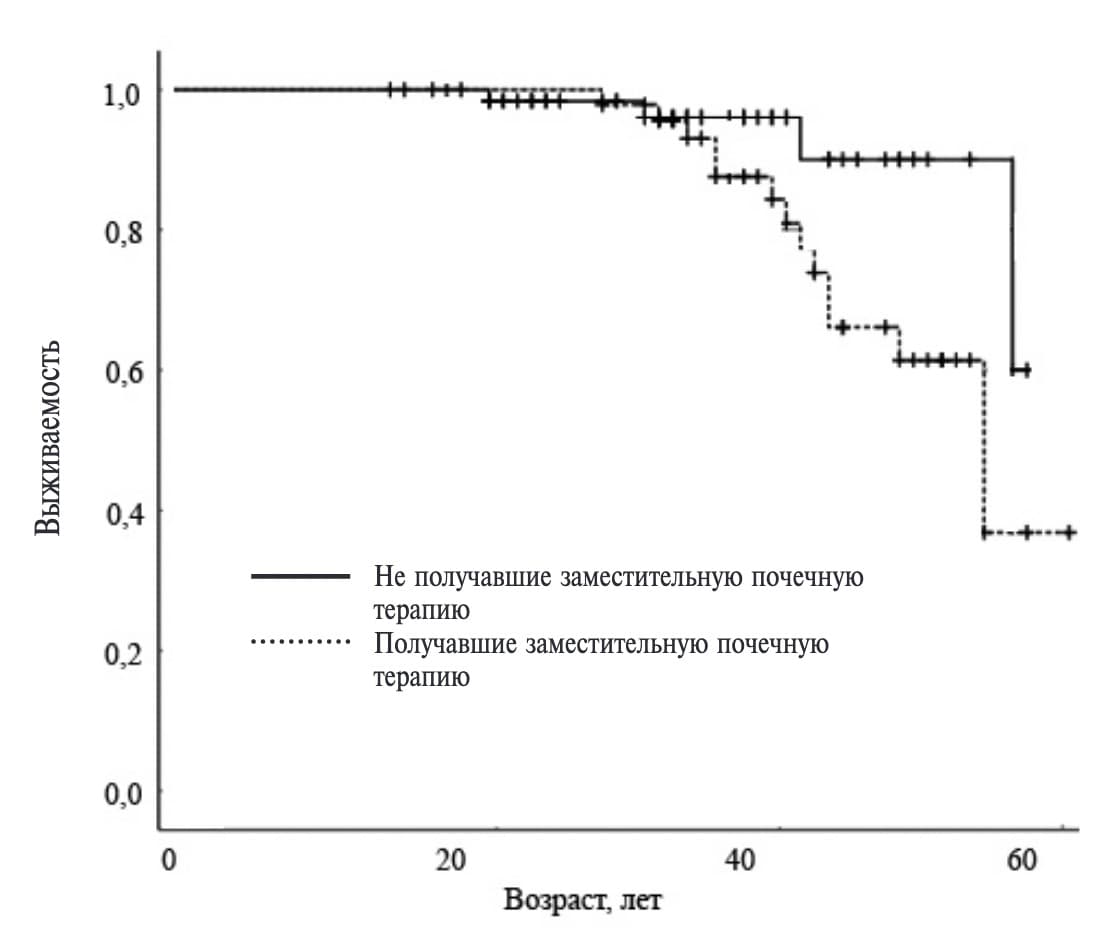
Среди обследованных 186 пациентов умерли 18 (9,7%) больных (медиана возраста на момент смерти составила 44,5 [37,0;47,0] лет), в том числе 14 пациентов – в возрасте от 30 до 50 лет. Семнадцать (94,4%) из 18 больных с БФ умерли от сердечно-сосудистых причин, в том числе 15 – внезапно и 2 – от повторного инсульта. Все умершие пациенты были мужчинами, а 14 из них находились на лечении гемодиализом. 13 из 14 больных, получавших почечную заместительную терапию, умерли внезапно, а 1 – от инфекции. Среди пациентов, получавших заместительную почечную терапию, смертность была значительно выше, чем во всей выборке, и достигла 28,5% (14/49) (рис. 2). У всех этих пациентов определялась выраженная гипертрофия миокарда ЛЖ.
Обсуждение
В нашем исследовании гипертрофия левого желудочка при МРТ была выявлена у 50% взрослых пациентов с БФ. У мужчин ее частота была почти в два раза выше, чем у женщин (61% и 35%, соответственно), хотя разница не достигла статистической значимости. По данным метода Каплана-Мейера, вероятность наличия гипертрофии миокарда увеличивалась с возрастом, а у мужчин она развивалась примерно на 10 лет раньше, чем у женщин. Похожие результаты были получены в зарубежных исследованиях [16,17], в том числе с применением МРТ [18,19], которую считают более надежным методом оценки гипертрофии ЛЖ при этом заболевании [20]. У 55% больных отмечалось асимметричное утолщение межжелудочковой перегородки, которое в одном случае сопровождалось обструкцией выносящего тракта левого желудочка, потребовавшей оперативного вмешательства. Выраженное утолщение миокарда, характеризовавшееся увеличением толщины межжелудочковой перегородки и/или задней стенки ЛЖ более 15 мм, определялось у 38% больных с гипертрофией ЛЖ и нередко сопровождалось развитием интрамиокардиального фиброза.
Основным проявлением поражения сердца при БФ в нашей когорте были аритмии, прежде всего фибрилляция предсердий, которая с одинаковой частотой встречалась у мужчин и женщин (8,7% и 5,6% соответственно, p=0,3). Развитие застойной сердечной недостаточности мы наблюдали у нескольких пациентов. Случаев достоверного инфаркта миокарда мы не зарегистрировали, хотя у некоторых больных боли в сердце и выраженные изменения на ЭКГ, связанные с гипертрофией миокарда, ошибочно трактовались врачами как проявления некроза сердечной мышцы. В регистре Fabry Outcomes Survey (FOS) частота инфаркта миокарда среди 704 пациентов с БФ составила всего 1,8%, а частота вмешательств на коронарных артериях – 0,7% [17].
У 16 (8,6%) из 186 больных поражение сердца (кардиалгии, аритмия и/или изменения на ЭКГ) было ведущим в картине заболевания, в связи с чем они обращались к кардиологу. У всех этих пациентов при эхокардиографии была выявлена гипертрофия миокарда, которая обычно трактовалась как гипертрофическая кардиомиопатия. Заподозрить диагноз БФ в таких случаях позволяют "классические"симптомы, такие как нейропатическая боль, сниженное потоотделение, ангиокератомы, вихревидная кератопатия, системность заболевания, в том числе поражение почек (протеинурия, обычно не достигающая нефротического уровня, снижение расчетной СКФ) и головного мозга (очаги в белом веществе головного мозга на МРТ и/или инсульт), и/или наличие заболевания у родственников пациента. При анализе семейного анамнеза необходимо учитывать, что фенотипы БФ в одной семье могут отличаться, поэтому следует обращать внимание не только на наличие поражения сердца, развившегося в молодом возрасте, но и другие возможные проявления БФ, например, лечение гемодиализом или инсульт.
Гипертрофия миокарда может быть единственным клиническим проявлением БФ, прежде всего у пациентов с поздним, или атипичным, вариантом заболевания. В таких случаях установить диагноз можно только путем скрининга, который оправдан у всех пациентов с гипертрофией миокарда неясного происхождения. По данным мета-анализа скрининговых исследований, частота выявления патогенных мутаций гена GLA среди больных с гипертрофией левого желудочка неясного генеза составляет около 1% [21]. В российской выборке БФ была выявлена у 0,4% из 1009 взрослых пациентов в возрасте 59±13 лет с гипертрофией ЛЖ неясного генеза [22]. Таким образом, БФ может быть диагностирована примерно у каждого сотого пациента с гипертрофической кардиомиопатией, а последующее обследование родственников пациента позволяет установить диагноз БФ еще у нескольких членов семьи, что повышает экономическую целесообразность скрининга. В российской выборке на одного пробанда с БФ приходилось в среднем еще два члена семьи, у которых также имелось это заболевание [23].
При обсуждении возможных причин гипертрофии левого желудочка неясного генеза необходимо учитывать, что тяжелое поражение сердца, развившееся в детском или подростковом возрасте, нехарактерно для БФ, но может наблюдаться при некоторых других редких наследственных заболеваниях, таких как болезнь Данона [24]. В нашем исследовании медиана возраста пациентов с "кардиальным" фенотипом БФ, у которых обсуждался диагноз гипертрофической кардиомиопатии, составила 58 лет, т.е. была выше, чем в выборке в целом. Следует отметить и большую долю женщин среди этих пациентов (75,0%). Сходные данные приводят и зарубежные авторы, которые указывают на более высокую частоту диагностики БФ среди пациентов с гипертрофией ЛЖ неясного генеза, развившейся в зрелом возрасте, особенно среди женщин. B. Sachdev и соавт. диагностировали БФ у 5 (6,3%) из 79 мужчин с гипертрофической кардиомиопатией, диагностированной в возрасте ≥40 лет (средний возраст 52,9±7,7 лет), и только у 1 (1,4%) из 74 мужчин, у которых гипертрофия миокарда неясного генеза была выявлена в возрасте <40 лет (средний возраст 25,9±9,2 лет) [25]. В другом исследовании среди 34 женщин, у которых гипертрофическая кардиомиопатия была диагностирована в возрасте 50±13,6 лет, частота БФ, подтвержденной при биопсии миокарда и молекулярно-генетическом исследовании, достигла 12% [26].
Одним из фактором, способствующим прогрессированию гипертрофии ЛЖ у пациентов с БФ, является ХБП. Уремическая кардиомиопатия наблюдается более чем у 75% пациентов с ХБП и характеризуется гипертрофией и фиброзом миокарда, которые нарастают по мере ухудшения функции почек и сопровождаются увеличением риска смерти от сердечно-сосудистых причин, в том числе внезапной. Причины гипертрофии ЛЖ при ХБП включают в себя артериальную гипертонию, анемию, увеличение активности нейрогуморальных систем, накопление уремических токсинов и другие факторы [27]. В исследованной нами когорте у 2/3 больных с выраженной гипертрофией ЛЖ имелась терминальная стадия ХБП. При этом 14 (77,8%) из 18 умерших пациентов с БФ получали заместительную почечную терапию, а 13 из них умерли внезапно. Среди пациентов с терминальной стадией ХБП смертность достигла 28,5% и значительно превышала таковую среди пациентов, у которых нарушение функции почек отсутствовало или было менее тяжелым (2,9%).
Гипертрофия ЛЖ, в том числе сочетавшаяся с фиброзом миокарда, у большинства обследованных нами пациентов с БФ не сопровождалась снижением фракции выброса ЛЖ. Тем не менее, при speckle-tracking эхокардиографии у пациентов с гипертрофией миокарда мы выявили снижение глобальной продольной деформации (GLS) ЛЖ, показателя глобальной конструктивной работы (GCW), эффективности глобальной работы (GWE) и повышение показателя работы впустую (GWW). Сходные данные приводят и зарубежные авторы. L. Spinelli и соавт. в ретроспективном исследовании у 96 взрослых пациентов с БФ (средний возраст около 42 лет) показали, что GLS и показатели работы миокарда являются независимыми предикторами неблагоприятных исходов, включая смерть от сердечных причин, желудочковую тахикардию, фибрилляцию предсердий и тяжелую сердечную недостаточность, в течение 2-летнего наблюдения [28]. Изучение особенностей и локализации миокардиальной дисфункции с помощью speckle-tracking эхокардиографии может иметь и определенное диагностическое значение при оценке возможных причин утолщения стенки ЛЖ [29].
В соответствии с российскими рекомендациями по диагностике и лечению БФ, одобренными Минздравом России, поражение сердца как у мужчин, так и женщин является показанием для назначения ферментозаместительной терапии (ФЗТ) рекомбинантными препаратами α-галактозидазы А – агалсидазой альфа или агалсидазой бета, эффективность и безопасность которых установлены как в рандомизированных контролируемых, так и наблюдательных исследованиях [30,31]. В одном из первых рандомизированных контролируемых исследованиях с помощью повторных биопсий сердца было показано, что лечение агалсидазой бета (Фабразим) в дозе 1 мг/кг каждые две недели вызывает уменьшение депозитов глоботриаозилцерамида в эндотелии сосудов миокарда [32]. В наблюдательных исследованиях длительностью до 10 лет лечение тем же препаратом вызывало уменьшение или стабилизацию индекса ММЛЖ, причем эффективность терапии была выше, если ее начинали в более молодом возрасте, когда у пациентов с БФ еще отсутствуют необратимые изменения сердца и других органов-мишеней [33]. Необходимо отметить, что ФЗТ оказывает благоприятное влияние и на другие проявления БФ, в том числе вызывает уменьшение нейропатической боли, улучшение потоотделения, стабилизацию функции почек, улучшение качества жизни.
Наше исследование имеет ограничения. МРТ сердца по разным причинам была выполнена не всем пациентам, включенным в исследование, поэтому при оценке исходов поражения сердца мы учитывали данные не только МРТ, но и эхокардиографии, которая остается основным методом диагностики гипертрофии ЛЖ в клинической практике. Количество пациентов, которым была проведена speckle-tracking эхокардиография, было относительно небольшим. Кроме того, мы не изучали влияние ФЗТ на течение поражения сердца, так как срок наблюдения у многих пациентов, начавших лечение, был недостаточным для адекватной оценки его результатов. Тем не менее, в наше исследование было включено большинство взрослых российских пациентов с БФ, что позволило изучить особенности поражения сердца при этом заболевании в российской популяции.
Заключение
Поражение сердца наблюдалось примерно у половины обследованных взрослых пациентов с БФ и характеризовалось развитием симметричной или асимметричной гипертрофии ЛЖ, часто сочетавшейся с фиброзом миокарда, который может быть выявлен при МРТ с контрастированием гадолинием. Несмотря на сохранную фракцию выброса ЛЖ, гипертрофия миокарда при БФ сопровождалась снижением GLS и ухудшением показателей работы миокарда. У части больных поражение сердца было ведущим в клинической картине заболевания и в некоторых случаях не сопровождалось клиническими симптомами, которые обычно позволяют заподозрить диагноз БФ, такими как нейропатическая боль, ангиокератомы и/или сниженное потоотделение. В связи с этим БФ необходимо исключать у всех взрослых пациентов с диагнозом гипертрофической кардиомиопатии или гипертрофии ЛЖ неясного генеза. С этой целью следует проводить молекулярно-генетическое исследование и определять активность α-галактозидазы А (у мужчин) и содержание Lyso-GL3 в высушенных пятнах крови. Существенный вклад в прогрессирование гипертрофии ЛЖ у пациентов с БФ вносит ХБП, а необходимость в заместительной почечной терапии сопровождается значительным увеличением смертности от сердечных причин.
Используемые источники
- Zarate YA, Hopkin RJ. Fabry’s disease. Lancet 2008;372:1427–35.
- Germain DP. Fabry disease. Orphanet J Rare Dis 2010;5:30.
- Nair V, Belanger EC, Veinot JP. Lysosomal storage disorders affecting the heart: a review. Cardiovasc Pathol 2019;39:12-24.
- Linhart A, Paleček T. Narrative review on Morbus Fabry: diagnosis and management of cardiac manifestations. Cardiovasc Diagn Ther 2021;11(2):650-660.
- Pieroni M. Поражение сердца при болезни Фабри: новые механизмы развития и подходы к лечению. Клин фармакол тер 2021;30(2):6-16 [Pieroni M. Cardiomyopathy in Fabry disease: insights in the pathogenesis and new treatment options. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(2):6-16 (In Russ.)].
- Nordin S, Kozor R, Medina-Menacho K, et al. Proposed stages of myocardial phenotype development in Fabry disease. J Am Coll Cardiol Img 2019;12:1673-83.
- Schiffmann R, Hughes DA, Linthorst GE, et al. Screening, diagnosis, and management of patients with Fabry disease: conclusions from a “Kidney Disease: Improving Global Outcomes” (KDIGO) Controversies Conference. Kidney Int 2017;91(2):284293.
- Hsu TR, Hung SC, Chang FP, et al. Later onset Fabry disease, cardiac damage progress in silence: experience with a highly prevalent mutation. J Am Coll Cardiol 2016;68:2554-63.
- Моисеев С.В., Намазова-Баранова Л.С., Савостьянов К.В. и др. Распространенность и клинические проявления болезни Фабри у диализных пациентов. Клин фармакол тер 2017;26(2):27-33 [Moiseev SV, NamazovaBaranova LS, Savostyanov KV, et al. Prevalence and clinical features of Fabry disease in dialysis patients. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2017;26(2):27-33 (In Russ.)].
- Моисеев С.В., Каровайкина Е.А., Буланов Н.М. и др. Предикторы клинических исходов болезни Фабри: роль хронической болезни почек. Терапевтический архив 2019;91(6):40–6 [Moiseev SV, Karovaikina EA, Bulanov NM, et al. Predictors of clinical events in patients with Fabry disease: the role of chronic kidney disease. Terapevticheskiy arkhiv 2019;91(6):40–6 (In Russ.)].
- Моисеев С.В., Тао Е.А., Моисеев А.С. и др. Клинические проявления и исходы болезни Фабри у 150 взрослых пациентов. Клин фармакол тер 2021;30(3):43-51 [Moiseev S, Tao E, Moiseev A, et al. Clinical manifestations and outcomes of Fabry disease in 150 adult patients. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(3):43-51 (In Russ.)].
- Моисеев А.С., Тао Е.А., Буланов Н.М. и др. Поражение центральной нервной системы при болезни Фабри. Клин фармакол тер 2022;31(1):32-8 [Moiseev A, Tao E, Bulanov N, et al. Central nervous system involvement in Fabry disease. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2022;31(1):32-8 (In Russ.)].
- Smid BE, van der Tol L, Cecchi F, et al. Uncertain diagnosis of Fabry disease: consensus recommendation on diagnosis in adults with left ventricular hypertrophy and genetic variants of unknown significance. Int J Cardiol 2014;177:400-8.
- Levey AS, Eckardt KU, Dorman NM, et al. Nomenclature for kidney function and disease: report of a Kidney Disease: Improving Global Outcomes (KDIGO) Consensus Conference. Kidney Int 2020;97(6):1117-29.
- Kawel-Boehm N, Maceira A, Valsangiacomo-Buechel ER, et al. Normal values for cardiovascular magnetic resonance in adults and children. J Cardiovasc Magn Reson 2015;17:29.
- Kampmann C, Linhart A, Baehner F, et al. Onset and progression of the Anderson-Fabry disease related cardiomyopathy. Int J Cardiol 2008;130:367–73.
- Linhart A, Kampmann C, Zamorano J, et al. Cardiac manifestations of Anderson-Fabry disease: results from the international Fabry outcome survey. Eur Heart J 2007;28:1228–35.
- Deva DР, Hanneman K, Li Q, et al. Cardiovascular magnetic resonance demonstration of the spectrum of morphological phenotypes and patterns of myocardial scarring in Anderson-Fabry disease. J Cardiovasc Magnetic Resonance 2016;18:14.
- Kozor R, Grieve SM, Tchan MC, et al. Cardiac involvement in genotype-positive Fabry disease patients assessed by cardiovascular MR. Heart 2016;102(4):298-302.
- O'Brien C, Britton I, Karur GR, et al. Left ventricular mass and wall thickness measurements using echocardiography and cardiac MRI in patients with Fabry disease: clinical significance of discrepant findings. Radiol Cardiothorac Imaging 2020;2(3):e190149.
- Doheny D, Srinivasan R, Pagant S, et al. Fabry Disease: prevalence of affected males and heterozygotes with pathogenic GLA mutations identified by screening renal, cardiac and stroke clinics, 1995-2017. J Med Genet 2018;55(4):261-8.
- Savostyanov K, Pushkov A, Zhanin I, et al. The prevalence of Fabry disease among 1009 unrelated patients with hypertrophic cardiomyopathy: a Russian nationwide screening program using NGS technology. Orphanet J Rare Dis 2022;17(1):199.
- Тао Е.А., Моисеев А.С., Новиков П.И. и др. Эффективность семейного скрининга при болезни Фабри в Российской популяции. Клин фармакол тер 2020;29(2):34-39 [Tao E, Moiseev A, Novikov P, et al. Efficacy of family screening in Fabry disease in the Russian population. Clin Pharmacol Ther = Klinicheskaya farmakologiya i terapiya 2020;29(2):34-39 (In Russ.].
- Моисеев С.В., Привалова Е.В., Рамеев В.В. и др. Гипертрофия левого желудочка неясной этиологии. Клин фармакол тер 2019;28(2):77-83 [Moiseev SV, Privalova EV, Rameev VV, et al. Unexplained left ventricular hypertrophy. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2019;28(2):77-83 (In Russ.)].
- Sachdev B, Takenaka T, Teraguchi H, et al. Prevalence of Anderson-Fabry disease in male patients with late onset hypertrophic cardiomyopathy. Circulation 2002;105(12):1407-11.
- Chimenti C, Pieroni M, Morgante E, et al. Prevalence of Fabry disease in female patients with late-onset hypertrophic cardiomyopathy. Circulation 2004;110(9):1047-53.
- Patel N, Yaqoob MM, Aksentijevic D. Cardiac metabolic remodelling in chronic kidney disease. Nat Rev Nephrol 2022;18(8):524-37.
- Spinelli L, Giugliano G, Pisani A, et al. Does left ventricular function predict cardiac outcome in Anderson-Fabry disease? Int J Cardiovasc Imaging 2021;37(4): 1225-8.
- Tanaka H. Efficacy of echocardiography for differential diagnosis of left ventricular hypertrophy: special focus on speckle-tracking longitudinal strain. J Echo -cardiogr 2021:19(2):71-9.
- Germain DP, Elliott PM, Falissard B, et al. The effect of enzyme replacement therapy on clinical outcomes in male patients with Fabry disease: A systematic literature review by a European panel of experts. Mol Genet Metab Rep 2019;19:100454.
- Germain DP, Arad M, Burlina A, et al. The effect of enzyme replacement therapy on clinical outcomes in female patients with Fabry disease - A systematic literature review by a European panel of experts. Mol Genet Metab 2019;126(3):224-235.
- Eng CM, Guffon N, Wilcox WR, et al; International Collaborative Fabry Disease Study Group. Safety and efficacy of recombinant human alpha-galactosidase A replacement therapy in Fabry's disease. N Engl J Med 2001;345(1):9-16.
- Germain DP, Charrow J, Desnick RJ, et al. Ten-year outcome of enzyme replacement therapy with agalsidase beta in patients with Fabry disease. J Med Genet 2015;52(5):353-8.
