Практические аспекты применения левилимаба, нового ингибитора рецептора интерлейкина-6, при ревматоидном артрите
Левилимаб – это моноклональное антитело, взаимодействующее с рецепторами интерлейкина-6 и обладающее выраженной противовоспалительной активностью. Эффективность и безопасность левилимаба в лечении ревматоидного артрита установлены в многоцентровых, двойных слепых, рандомизированных, плацебо-контролируемых исследованиях AURORA и SOLAR. В статье на основании двух клинических наблюдений обсуждаются различные аспекты применения левилимаба у больных ревматоидным артритом.
С.В. Моисеев. Левилимаб (Илсира) – это новый оригинальный ингибитор рецептора интерлейкина (ИЛ-6), зарегистрированный в Российской Федерации под торговым наиме нованием Илсира для лечения ревматоидного артрита (РА) умеренной или высокой степени активности у взрослых при отсутствии адекватного ответа на терапию одним или несколькими базисными препаратами, в том числе для торможения прогрессирования рентгенологических изменений, и патогенетической терапии COVID19 [1,2].
ИЛ-6 – один из ключевых медиаторов воспаления, который играет важную роль в патогенезе не только поражения суставов, но и внесуставных проявлений РА [3,4]. ИЛ-6 связывается со специфическими рецепторами, экспрессирующимися на мембранах различных клеток, и циркулирующими растворимыми рецепторами и вызывает воспалительный каскад за счет активации сигнальных систем, в частности янус-киназ [5]. Левилимаб представляет собой моноклональное антитело, которое взаимодействует с растворимыми и мембранными рецепторами ИЛ-6 и препятствует активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, избыточной продукции других провоспалительных цитокинов и острофазовых белков [6]. Выпускается в виде раствора для подкожного введения (в одном заранее заполненном шприце содержится 162 мг лекарственного вещества), который вводят один раз в неделю. В каких случаях у пациентов с РА целесообразно применение левилимаба?
П.И. Новиков. В соответствии с инструкцией, левилимаб следует назначать взрослым пациентам с РА умеренной или высокой степени активности, которые не ответили на лечение по крайней мере одним стандартным базисным противововоспалительным препаратом (БПВП). Это положение соответствует принципам лечения РА, изложенным как в отечественных, так и европейских рекомендациях [7,8]. Препа ратом первой линии у пациентов с РА остается метотрексат, рекомендуемая доза которого составляет 20-25 мг/нед, а альтернативными – лефлуномид и сульфасалазин. При плохой переносимости метотрексата для приема внутрь целесообразно проводить подкожное введение препарата. Если монотерапия или комбинированная терапия стандартными БПВП не позволяет достичь ремиссии или низкой активности РА в течение 6 мес, показано назначение генно-инженерного биологического препарата (ГИБП) или ингибитора янус-киназ. Доводом в пользу более раннего (например, при недостаточной эффективности первого стандартного БПВП) присоединения указанных препаратов является наличие неблагоприятных прогностических факторов, позволяющих предсказать прогрессирование заболевания, таких как сохранение высоких уровней острофазовых белков и счета опухших суставов, наличие ревматоидного фактора (РФ) и/или антител к цитруллинированному пептиду (АЦЦП), особенно в высоких титрах, наличие ранних эрозий [8]. Считается, что ГИБП различных групп и ингибиторы янус-киназ существенно не отличаются по эффективности в лечении РА, поэтому для терапии второй линии может быть использован любой из них, в том числе левилимаб, а не только ингибиторы фактора некроза опухоли-a, как рекомендовалось ранее.
С.В. Моисеев. Чем подтверждается эффективность левилимаба у пациентов с РА?
Н.Р. Носова. Эффективность и безопасность левилимаба у больных РА были установлены в клинических исследованиях 2 и 3 фазы AURORA и SOLAR, соответственно [9,10]. В международное, многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое клиническое исследование SOLAR были включены 154 пациента с активным РА, у которых была недостаточно эффективной монотерапия метотрексатом в дозе 15-25 мг/нед. Основными показателями эффективности в этом исследовании были доля пациентов, достигших ответа по критериям Американской коллегии ревматологов (ACR20) через 12 недель, и доля пациентов с низкой активностью РА (DAS28-СРБ <3,2) через 24 недели. Кроме того, изучали различные дополнительные показатели эффективности, в том числе частоту ответа на лечение по критериям EULAR, изменения индексов активности РА, лабораторных показателей воспаления и рентгенологических признаков деструкции суставов. Во время 24-недельного двойного слепого периода исследования пациенты получали левилимаб в дозе 162 мг/нед (n=102) или плацебо (n=52) в сочетании с метотрексатом в прежней дозе.
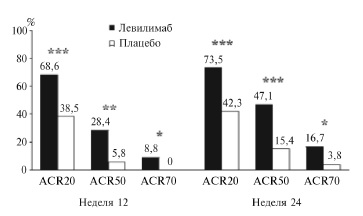
По обоим первичным показателям эффективности левилимаб достоверно превосходил плацебо. Через 12 недель частота ответа по критериям ACR20 составила 68,6% и 38,5% в группах левилимаба и плацебо, соответственно (p=0,0003), а через 24 недели частота достижения низкой активности РА – 60,8% и 3,8% (p<0,0001). Эффективность левилимаба подтверждалась также результатами анализа более выраженного ответа по критериям ACR (ACR50 и ACR70) (рис. 1), динамики индексов активности РА, в частности DAS28-СРБ и CDAI, и лабораторных маркеров воспаления (СОЭ и концентрации С-реактивного белка). Кроме того, лечение левилимабом по сравнению с плацебо привело к уменьшению выраженности функциональной недостаточности (опросник HAQ-DI) и улучшению качества жизни (опросник EQ-5D-3L).
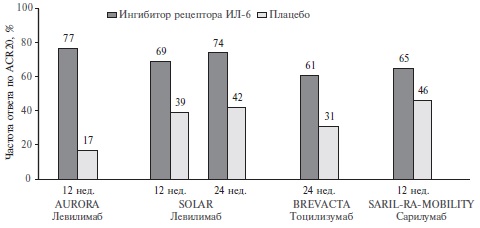
Прямые сравнительные исследования левилимаба и других ингибиторов рецептора ИЛ-6 у больных РА не проводились, однако частота ответа на лечение тоцилизумабом и сарилумабом в рандомизированных, плацебо-контролируемых исследованиях BREVACTA и SARIL-RA-MOBILITY, проводившихся по похожим протоколам, была сходной с таковой в исследованиях AURORA и SOLAR (рис. 2) [11,12]. Частота ответа на лечение в клинических исследованиях в значительной степени зависит от особенностей выборок больных, которые могут существенно отличаться даже при сопоставимых критериях отбора. При сравнительном анализе ориентиром может служить частота ответа на лечение в группе плацебо, которая была сопоставимой в исследованиях левилимаба и тоцилизумаба, но выше в исследовании сарилумаба. Соответственно, в последнем исследовании можно было ожидать и более высокой частоты ответа на лечение активным препаратом, однако она была сходной с таковой в исследованиях двух других ингибиторов рецептора ИЛ-6. Конечно, эти данные не позволяют сделать окончательный вывод, но дают возможность предположить, что левилимаб по крайней мере не уступает по эффективности зарегистрированным ранее ингибиторам рецептора ИЛ-6.
С.В. Моисеев. Одним из трендов современной ревматологии является стремление ограничить применение глюкокортикостероидов (ГКС) для лечения РА и других иммуновоспалительных заболеваний путем назначения более низких стартовых доз, быстрого их снижения, сокращения длительности терапии, раннего применения стандартных и таргетных БПВП и ГИБП. В последних рекомендациях EULAR 2019 г. по лечению РА указано, что ГКС могут применяться в сочетании со стандартными БПВП, в том числе в случае замены препарата, для подавления активности заболевания, однако их следует как можно быстрее отменить, предпочтительно в течение первых 3 мес (не более 6 мес) [8]. В рекомендациях Американской коллегии ревматологов предложено избегать назначения ГКС даже на короткий срок, хотя эксперты допустили их применение для bridge-терапии (от англ. bridge – мост) при необходимости достижения быстрого симптоматического эффекта у пациентов с РА, начавших прием БПВП, действие которых проявляется не сразу [13].
Однако на практике далеко не все пациенты с РА прекращают прием ГКС. Например, в крупном американском исследовании (n=12749) 21-25% больных РА продолжали прием этих препаратов несмотря на то, что у них были достигнуты ремиссия или минимальная активность заболевания [14]. По данным систематизированного обзора литературы, в клинических исследованиях доля пациентов, продолжавших или возобновивших прием ГКС, через 1 год после начала лечения составила в среднем 22%, а через 2 года – 10% [15]. Последние показатели представляются заниженными, так как в обычной клинической практике доля пациентов с РА, длительно принимающих ГКС, достигала 40-50% [16]. Имеющиеся данные свидетельствуют о том, что имеется несоответствие между рекомендациями профессиональных обществ и клинической практикой. Чем это объясняется?
П.И. Новиков. Данные о частоте прекращения прие ма ГКС у пациентов с РА в клинической практике вариабельны и зависят не только от истинной частоты стероидозависимости, но и других факторов, таких как год публикации, тип исследования (клиническое иссле дование, которое проводится по определенному прото колу, или анализ реальной практики лечения), доступность современных базисных препаратов в стра не или регионе и др. Не вызывает сомнения, что ГКС обладают высокой противовоспалительной эффектив ностью и в большинстве случаев позволяют достичь быстрого уменьшения активности РА у пациентов, не отвечающих на лечение нестероидными противовоспа лительными препаратами (НПВП) или БПВП. Быстрое симптоматическое действие ГКС было показано еще 70 лет назад, когда P. Hench, ревматолог из клиники Мейо, впервые использовал кортизон для лечения пациентки с тяжелым РА. Несмотря на разработку раз личных БПВП и ГИБП, преднизолон и другие ГКС не утратили значения в лечении РА, хотя, как указано выше, сегодня их рекомендуют назначать на относи тельно короткий срок (не более 3-6 мес) и по возмож ности быстро отменять, когда проявится действие базисной терапии. Основным доводом в пользу огра ничения применения ГКС являются многочисленные нежелательные эффекты, такие как остеопороз, ката ракта, увеличение риска инфекционных и сердечно сосудистых осложнений и др., которые наблюдаются при лечении даже очень низкими дозами ГКС.
Тем не менее, прекратить bridge-терапию ГКС удает ся не у всех пациентов с РА. J. Maassen и соавт. изучили частоту успешного (т.е. не сопровождавшегося ухудше нием состояния) снижения дозы и отмены преднизоло на у пациентов с РА, получавших стандартные БПВП, в исследованиях BeSt и IMPROVED [17]. В целом при мерно у 40% пациентов, включенных в эти исследова ния, после отмены ГКС развился рецидив РА, хотя все они продолжали базисную терапию. Длительное приме нение ГКС у больных РА может быть и вынужденной мерой, например, в случае плохой переносимости стан дартных БПВП и/или недоступности таргетных БПВП или ГИБП.
Одновременно продолжается дискуссия по поводу целесообразности длительного применения низких доз (<7,5 мг/сут в пересчете на преднизолон) ГКС у более широкого круга больных РА, т.е. при отсутствии стероидозависимости. В недавно опубликованном двойном слепом, плацебо-контролируемом, рандомизи рованном исследовании GLORIA оценивали эффектив ность 2-летней терапии преднизолоном в дозе 5 мг/сут у 451 пациента в возрасте старше 65 лет (в среднем 72 года) с длительным РА [18]. 79% больных, включенных в исследование, получали базисные препараты, в том числе ГИБП. По сравнению с плацебо лечение ГКС привело к снижению активности РА и замедлению про грессирования структурных изменений суставов. При этом риск нежелательных явлений увеличился в 1,24 раза (p=0,02), но в основном за счет нетяжелых инфек ций. По мнению авторов, присоединение ГКС в низкой дозе к патогенетической терапии у пожилых пациентов с длительным анамнезом РА характеризуется положи тельным балансом между пользой и вредом лечения.
Хотя результаты исследования GLORIA и других исследований указывают на допустимость длительного применения низких доз ГКС в дополнение к базисной Хотя результаты исследования GLORIA и других исследований указывают на допустимость длительного применения низких доз ГКС в дополнение к базисной терапии у части больных РА, тем не менее, необходимо еще раз подчеркнуть, что эксперты профессиональных обществ рекомендуют рассматривать невозможность отмены ГКС как критерий неэффективности соответ ствующей фазы лечения и основание для его модифи кации. Одним из возможных вариантов является назначение ингибиторов рецептора ИЛ-6, которые обладают выраженной противовоспалительной актив ностью за счет блокады одного из ключевых медиаторов воспаления и, соответственно, позволяют преодолеть стероидозависимость у больных РА, что демонстрирует следующее наблюдение.
В.Е. Логина. Больная Г., 65 лет, пенсионерка. В 2019 г. появились боли в коленных суставах, по поводу чего наблюдалась у травматолога с диагнозом остеоартрита. Неоднократно получала курсами внутрь и внутрисустав но различные SYSADOA. В 2020 г. присоединились боли в плечевых суставах, отмечались рецидивирующие синовиты коленных суставов. Практически ежемесячно проводились пункции коленных суставов с введением бетаметазона с кратковременным эффектом. В январе 2021 г. после ОРЗ появились боли и припухание левого лучезапястного сустава с последующим вовлечением пястно-фаланговых и локтевых суставов, утренняя ско ванность в суставах кистей. При амбулаторном обследо вании выявлено увеличение титра АЦЦП (166 Ме/мл), содержания С-реактивного белка (СРБ; 104 мг/л) и СОЭ (27 мм/ч). Ревматоидный фактор отрицательный. Консультирована ревматологом, который диагностиро вал ревматоидный артрит. Проведена пульс-терапия метипреднизолоном по 500 мг №3, начато лечение мет ротрексатом подкожно 10 мг/нед с последующим повы шением дозы до 15, а затем 20 мг/нед, однако препарат был отменен после 5 инъекций из-за выраженной дис пепсии. В течение 2 месяцев принимала лефлуномид 20 мг/сут, который также пришлось отменить из-за диа реи. Проводилась комбинированная терапия гидрокси хлорохином 400 мг/сут и сульфасалазином 3 г/сут, которая была недостаточно эффективной. С целью контроля активности болезни постоянно принимала преднизолон в дозе 20 мг/сут. Тем не менее, сохраня лась высокая лабораторная активность системного вос паления, нарастала анемия, эпизодически обострение артрита и повышение температуры тела. Подвижность пациентки была резко ограничена (могла перемещаться только по комнате с посторонней помощью). При обследовании в клинике подтвежден диагноз рев ма тоидного артрита (серопозитивного полиартрита) высо кой активности (DAS28 – 6,1) с системными проявлениями (лихорадка, анемия) и функциональной недостаточностью 2-3 степени.
Учитывая пожилой возраст, плохую переносимость стандартной иммуносупрессивной терапии, высокую активность болезни, наличие системных проявлений и стероидозависимости, начато лечение левилимабом в дозе 162 мг подкожно один раз в неделю. Состояние пациентки быстро улучшилось: разрешение артритов, нормализация температуры тела, улучшение общего самочувствия и увеличение подвижности (может само стоятельно ходить по палате с помощью костыля). В результате терапии левилимабом в течение 2 месяцев удалось полностью отказаться от ГКС и отменить суль фасалазин (прием гидроксихлорохина был продолжен). При этом отмечается сохранение низкой активности – ремиссии ревматоидного артрита (клинически и лабо раторно). К настоящему моменту продолжительность приема левилимаба составляет более 9 месяцев, нежела тельных эффектов препарата не отмечено.
Н.Р. Носова. Таким образом, применение левилимаба привело к быстрому улучшению состояния пожилой пациентки с активным РА, длительно принимавшей ГКС, и позволило снизить дозу преднизолона и в конечном итоге отменить этот препарат. Эффективность такого подхода косвенно подтверждается и результатами клинических исследований других инги биторов рецептора ИЛ-6. В программе TOZURA, вклю чавшей в себя 11 клинических исследований, которые проводились в 22 странах, была проанализирована частота ответа на лечение тоцилизумабом в зависимости от одновременного приема ГКС [19]. Среди 1804 боль ных активным РА 145 получали тоцилизумаб и ГКС, 208 – тоцилизумаб без ГКС, 730 – комбинированную терапию тоцилизумабом, стандартными БПВП и ГКС и 721 – комбинированную терапию тоцилизумабом, стандартными БПВП без ГКС. Медиана дозы ГКС состав ляла 5 мг/сут в пересчете на преднизолон (не более 10 мг/сут). Частота достижения клинической ремиссии РА (DAS-28<2,6) во всех подгруппах постепенно увеличи валась и в конце 24-недельного наблюдения достоверно не отличалась между подгруппами больных, получавших и не получавших ГКС. Результаты программы TOZURA не позволяют судить о возможной частоте прекращения приема ГКС у больных активным РА, получавших тоцилизумаб подкожно. Тем не менее, они показали, что продолжение приема ГКС после начала лечения ингибитором рецептора ИЛ-6 (± стандартными БПВП) не повлияло на эффективность терапии.
В двойном слепом, многоцентровом, рандомизированном, 24-недельном клиническом исследовании SEMIRA были сопоставлены результаты продолжения терапии преднизолоном в дозе 5 мг/сут или его отмены в течение 16 недель у 259 больных РА, получавших тоцилизумаб (± стандартные БПВП) [20]. В исследова ние включали пациентов, у которых была достигнута низкая активность РА при лечении тоцилизумабом и ГКС в дозе 5-15 мг, а доза преднизолона составляла 5 мг/сут в течение по крайней мере 4 недель. Доля паци ентов, у которых лечение было эффективным (низкая активность через 24 недели, отсутствие обострений РА в течение указанного срока и признаков надпочечнико вой недостаточности), в группе больных, продолжавших прием преднизолона была выше, чем в группе пациен тов, постепенно прекративших прием ГКС (77% и 65%, соответственно). Преимущество продолжения терапии ГКС было показано и при анализе динамики счета DAS28-СОЭ в двух группах. Таким образом, это исследование продемонстрировало преимущество продолже ния приема преднизолона в низкой дозе на фоне лече ния тоцилизумабом. Однако полученные данные можно рассмотреть и под другим углом: у 2/3 больных, полу чавших ингибитор рецептора ИЛ-6, отмена ГКС не привела к повышению активности РА, развитию обост рения заболевания или надпочечниковой недостаточно сти.
Е.И. Кузнецова. Невозможность снижения дозы преднизолона у больных РА, получающих адекватную базисную терапию, рассматривается как один из при знаков РА, трудно поддающегося лечению. В соответствии с определением, недавно предложенным EULAR, этот вариант РА может быть установлен при наличии трех критериев [21]:- (1) Неэффективность по крайней мере двух ГИБП или таргетных синтетических БПВП с различным механизмом действия у пациентов, не ответивших на стандартные БПВП.
- (2) Признаки активного/прогрессирующего заболевания (наличие по крайней мере одного из перечисленных ниже):
- а. Умеренная или высокая активность (например, DAS28-СОЭ >3,2 или CDAI >10).
- б. Лабораторные показатели и/или данные визуализирующих методов, указывающие на активность РА.
- в. Невозможность снижения дозы глюкокортикостероидов менее 7,5 мг/сут в пересчете на преднизолон.
- г. Быстрое прогрессирование рентгенологических изменений (± признаки активности), например, увеличение модифицированного счета Шарпа по крайней мере на 5 в год.
- д. Хорошо контролируемый РА, но сохранение симптомов, вызывающих снижение качества жизни.
- (3). По мнению ревматолога и/или пациента, лечение РА является проблематичным.
При наличии указанных критериев следует исключить возможность неправильного диагноза или наличия сопутствующих заболеваний, которые могут имитиро вать сохранение активности РА, таких как кристалличе ские артропатии, ревматическая полимиалгия, псориатический артрит, спондилоартрит, системная красная волчанка, системные васкулиты, реактивный артрит, паранеопластический синдром и др. Если наличие воспалительной активности вызывает сомнение, то для ее подтверждения или исключения может быть использован ультразвуковой метод. Причиной недостаточной эффективности базисной терапии может быть и низкая приверженность, частота которой у больных РА достигает 30-80% и может быть выше у пациентов с РА, трудно поддающимся лечению [21]. Важное значение в лечении таких пациентов (в дополнение к лекарственным средствам) могут иметь немедикаментозные мето ды (физические нагрузки, психотерапия и т.п.), которые помогают больным справиться с болью, утом ляемостью и функциональными нарушениями.
С.В. Моисеев. Следует ли применять левилимаб в комбинации с метотрексатом или другими стандартны ми БПВП, или возможна монотерапия ингибитором рецептора ИЛ-6?
П.И. Новиков. В исследовании SOLAR левилимаб у всех больных РА применяли в сочетании с метотрекса том, а эффективность монотерапии этим препаратом не изучалась. В связи с этим на практике левилимаб также следует назначать в комбинации с метотрексатом или другими стандартными БПВП, что позволяет повысить эффективность лечения. Тем не менее, в рекоменда циях EULAR отмечено, что в последние годы увеличи лась доля больных, которые по тем или иным причинам получают монотерапию ГИБП, например, из-за плохой переносимости метотрексата или противопоказаний к его применению [8]. В таких случаях ингибиторы ИЛ-6 могут иметь преимущество перед другими ГИБП. Например, в двойном слепом, рандомизированном, плацебо-контролируемом исследовании ACT-RAY у 556 больных активным РА несмотря на лечение метотрекса том сравнивали две стратегии дальнейшей терапии: присоединение тоцилизумаба к метотрексату или заме на последнего на ингибитор рецептора ИЛ-6 [22]. Через 24 недели частота ремиссии РА на фоне комбинирован ной терапии тоцилизумабом и метотрексатом была несколько выше, чем при монотерапии тоцилизумабом, однако разница не достигла статистической значимости (40,4% и 34,8%, соответственно; р=0,19). При этом частота ответа по критериям ACR была одинаковой в двух группах (ACR20: 71,5% и 70,3%, соответственно).
Однако имеются данные, указывающие на более высокую эффективность комбинированной терапии тоцилизумабом и метотрексатом по сравнению с моно терапией тоцилизумабом. В Японии в клиническое исследование SURPRISE, были включены 223 больных РА средней или высокой активности несмотря на лече ние метотрексатом [23]. Как и в исследовании ACTRAY, всем им назначали тоцилизумаб, который применяли в комбинации с метотрексатом или в виде монотерапии. Частота ремиссии РА через 24 недели у больных, получавших комбинированную терапию тоци лизумабом и метотрексатом, была выше, чем у больных, которых переводили на монотерапию тоцилизумабом (70% и 55%, соответственно; р=0,02), хотя через 52 недели она была сопоставимой в двух группах (72% и 70%; р=0,86). Кроме того, в первой группе была выявлена тенденция к замедлению прогрессирования рентгенологических изменений. Таким образом, в этом исследовании присоединение тоцилизумаба к метотрек сату привело к более быстрому подавлению активности РА и обеспечило более высокую эффективность лече ния по сравнению с монотерапией тоцилизумабом.
Хотя монотерапия ингибиторами рецептора ИЛ-6 может быть эффективной у части больных РА, не отве тивших на метотрексат, тем не менее, левилимаб целе сообразно применять в комбинации с этим препаратом или другими стандартными БПВП. Монотерапия леви лимабом возможна только при плохой переносимости последних или наличии противопоказаний к их приме нению.
С.В. Моисеев. Какова тактика лечения больных активным РА, которые ответили на терапию левилима бом в комбинации со стандартными БПВП? Возможны ли снижение доз или отмена ГИБП или БПВП?
Е.И. Кузнецова. Присоединение левилимаба к недостаточно эффективной терапии метотрексатом позво ляет не только улучшить результаты лечения, но и снизить дозу последнего (обычно до 10 мг/нед), что может иметь важное значение в случае плохой переносимости препарата. Побочные эффекты нередко наблю даются при применении метотрексата и могут препятствовать его назначению в рекомендуемой дозе 20-25 мг/нед. По данным систематизированного обзора 46 клинических исследований, общая частота нежелательных явлений при применении метотрексата соста вила в среднем 80,1% в рандомизированных клинических исследованиях и 23,1% в наблюдательных исследованиях [24]. Столь значительная разница часто ты нежелательных эффектов объясняется тем, что в рандомизированных клинических исследованиях реги стрируют все нежелательные события независимо от их предполагаемой связи с исследуемым препаратом. Более информативной является частота прекращения терапии из-за нежелательных явлений, которая, наоборот, была ниже в рандомизированных клинических исследованиях (6,7% и 15,5%, соответственно). Основными нежелательными эффектами были желу дочно-кишечные нарушения, которые отмечались при мерно в трети случаев. В недавно опубликованном британском когортном исследовании по крайней мере одно нежелательное явлений было зарегистрировано у 77,5% из 1069 больных ранним РА, которые впервые начали лечение метотрексатом. Чаще всего встречались желудочно-кишечные расстройства (42,0%), неврологи ческие нарушения (28,6%), изменения со стороны кожи и слизистых оболочек (26,0%) и легких (20,9%), повы шение активности печеночных аминотрансфераз (18,0%) и гематологические нарушения (5,6%) [25]. Основными побочными эффектами были тошнота (31,2%), утомляемость (29,4%) и головная боль (19,0%). Следует отметить, что большинство нежелательных явлений были несерьезными, а некоторые из них могли быть следствием одновременного приема других стан дартных БПВП.
Важное значение для профилактики нежелательных эффектов метотрексата имеет прием фолиевой кислоты. По данным систематизированного обзора Cochrane, лечение фолиевой кислотой у больных РА, получающих метотрексат, сопровождалось снижением риска развития желудочно-кишечных расстройств (тошноты, рвоты или боли в животе) на 26% (р=0,008), повышения активности аминотрансфераз на 77% (p<0,00001) и отмены метотрексата по любой причине на 61% (p<0,00001), а также тенденцией к снижению риска стоматита на 28% [26]. Улучшить переносимость метотрек сата позволяет подкожное его применение, характеризующееся также более высокой биодоступ ностью, что имеет важное значение при назначении рекомендуемых в настоящее время высоких доз метот рексата и их быстрого увеличения [27]. В прямом сравнительном исследовании было показано, что системная экспозиция метотрексата при приеме внутрь достигала плато при увеличении его дозы до ≥15 мг/нед, в то время как при подкожном введении препарата она линейно увеличивалась при повышении дозы до 20 и 25 мг/нед [28]. Следующее наблюдение иллю стрирует возможность снижения дозы метотрексата после назначения левилимаба пациенту с РА.
М.А. Литвинова. Больной А., 56 лет, водитель. С сентября 2013 г. отмечает появление боли и отека в левом коленном суставе и субфебрилитета (связывал с травмой). Принимал НПВП без выраженного эффекта. В ноябре 2013 г. появились розовые пятна диаметром около 1 см на коже спины и груди с последующем образованием пузырей. В январе 2014 г. консультирован ревматологом по месту жительства, выявлены ревматоидный фактор и АЦЦП, в связи с чем обсуждался диагноз РА. Назначены мелоксикам 15 мг/сут и сульфасалазин 2 г/сут. При обследовании в кожно-венериче ском диспансере диагностирована вульгарная пузырчатка. Проведена терапия преднизолоном в стартовой дозе 50 мг/сут, которая привела к полной эпите лизации всех эрозий. В последующем беспокоили боли и скованность в суставах кистей, лучезапястных и коленных суставах. Продолжал прием метилпреднизолона 4 мг/сут и мелоксикама с незначительным эффек том. С 2016 г. наблюдается в клинике имени Е.М. Тареева. С этого времени присоединились боль и отеч ность голеностопных суставов. При обследовании кон центрация СРБ составляла 16 мг/л, определялись ревматоидный фактор и АЦЦП. Подтвержден диагноз РА. К терапии добавлен метотрексат 15 мг/нед с постепенным увеличением дозы до 25 мг/нед. Доза метил преднизолона была временно увеличена до 8 мг/сут. Эффективность терапии была умеренной, периодически отмечалось ухудшение состояния. С 2019 г. посто янная комбинированная терапия метотрексатом 25 мг/нед, гидроксихлорохином 400 мг/сут и метилпред низолоном 2-6 мг/сут. С 2020 г. отмечено ухудшение переносимости метотрексата – диспепсия и повышение активности АСТ и АЛТ до 2-3 норм. В октябре 2021 г. при обследовании в клинике выявлена высокая активность РА: DAS28 – 6,58, СРБ – 33 мг/л, СОЭ – 36 мм/ч. Начато лечение левилимабом в дозе 162 мг/нед. Уже через 2 недели после начала лечения наблюдалось значительное уменьшение боли и скованности в суставах и улучшение лабораторных маркеров системного воспаления. В течение 2 месяцев доза метотрексата были снижена до 10 мг/нед, что привело к нормализации активности аминотрансфераз. В течение полугода удалось полностью отказаться от системных ГКС. Переносимость терапии левилимабом была хорошей. Припухлости и болезненности при пальпации в суставах нет. СОЭ – 9 мм/ч, СРБ – 0,6 мг/л, DAS28 – 2,2. Лечение продолжает в настоящее время, трудоспособность пациента сохранена.
С.В. Моисеев. В представленном наблюдении снижение дозы метотрексата диктовалось побочными эффектами препарата. Целесообразна ли модификация базисной терапии в случае хорошей переносимости стандартных БПВП?
Т.П. Шевцова. Снижение дозы и тем более отмена базисных препаратов могут привести к обострению РА и прогрессированию структурных изменений суставов, особенно при стойком повышении активности заболевания. Риск ухудшения состояния пациента может зависеть от разных факторов, в частности степени подавления активности РА и длительности достигнутой ремиссии. В рекомендациях EULAR указано, что “деэскалация” базисной терапии нецелесообразна при наличии низкой активности, а не ремиссии РА, учитывая более высокий риск обострений заболевания [8]. Желательная длительность ремиссии (например, 3, 6 или 12 мес), позволяющая обсуждать возможность снижения доз или отмены базисных препаратов, остается неясной. В некоторых исследованиях рекомендуемый срок составлял 6 мес, однако этот вопрос нуждается в дополнительном изучении.
По мнению экспертов EULAR, у пациентов со стойкой ремиссией РА в первую очередь необходимо стре миться к отмене ГКС, после чего могут обсуждаться снижение дозы и/или увеличение интервала дозирования ГИБП (например, введение левилимаба не каждую неделю, а каждые две недели) или ингибиторов янускиназ [8]. Эта рекомендация в первую очередь отражает более высокую стоимость последних по сравнению со стандартными БПВП. В ряде исследований изучался и альтернативный подход – продолжение лечения ГИБП и постепенная отмена стандартных БПВП. В исследование COMP-ACT были включены 296 больных РА, у которых была достигнута низкая активность заболевания (DAS28-СОЭ ≤3,2) при лечении метотрексатом и тоцилизумабом [29]. Больных рандомизировали на две группы и в течение 28 недель продолжали комбинированную терапию двумя препаратами или монотерапию тоцилизумабом. Среднее изменение счета DAS28-СОЭ, которое было первичным показателем эффективности, достоверно не отличалось между группами. Доля больных, у которых в конце исследования, определялась низкая активность или ремиссия РА, также была сопоставимой (низкая активность: 62,6% и 68,0% при моно терапии и комбинированной терапии, соответственно; ремиссия: 48,3% и 55,1%). Результаты данного исследования продемонстрировали безопасность отмены метотрексата после достижения низкой активности РА у пациентов, продолжающих лечение ингибитором рецептора ИЛ-6. Возможность успешной отмены стандартных БПВП подтверждается и результатами когорт ных исследований. Например, в регистре CORRONA около трети из 444 пациентов РА снизили дозу или отменили метотрексат после назначения тоцилизумаба [30].
Приведенные данные свидетельствуют о том, что попытки снижения доз или даже отмены базисных препаратов оправданны у больных РА, достигших стойкой ремиссии заболевания на фоне комбинированной тера пии. При сохранении остаточной активности РА необходимо быть осторожным, учитывая более высокий риск обострения заболевания. Вопрос о том, с какого препарата следует начинать “деэскалацию” базисной терапии – метотрексата или другого стандартного БПВП или ГИБП, необходимо решать индивидуально, в том числе с учетом эффективности и переносимости предыдущей терапии стандартными БПВП, предпочтений пациента, доступности ГИБП и т.д.
С.В. Моисеев. Левилимаб – оригинальный отечественный ингибитор рецептора ИЛ-6, разработка кото рого имеет очень важное значение для ревматологии. Эффективность и безопасность левилимаба подтверждены в рандомизированных контролируемых исследо ваниях у больных РА умеренной или высокой активности, сохраняющейся несмотря на лечение другими базисными препаратами.
Используемые источники
- Новиков П.И., Щеголева Е.М., Моисеев С.В. Эффективность и безопасность левилимаба, блокирующего рецепторы интерлейкина-6, в лечении ревматоидного артрита. Клин фармакол тер 2021;30(4):36-43 [Novikov P, Shchegoleva E, Moiseev S. Efficacy and safety of levilimab, a monoclonal antibody to interleukin-6 receptors, in patients with rheumatoid arthritis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(4):36-43 (In Russ.)].
- Новиков П.И., Бровко М.Ю., Шоломова В.И. и др. Левилимаб в лечении COVID-19. Клин фармакол тер 2021;30(3):67-75 [Novikov P, Brovko M, Sholomova V, et al. Levilimab, a monoclonal antibody to IL-6 receptors, in COVID-19. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(3):67-75 (In Russ.)].
- Srirangan S, Choy CH. The role of interleukin 6 in the pathophysiology of rheumatoid arthritis. Ther Adv Musculoskel Dis 2010;2(5):247–56.
- Dayer JM, Choy E. Therapeutic targets in rheumatoid arthritis: the interleukin-6 receptor. Rheumatology (Oxford) 2010;49:15–24.
- Heinrich PC, Behrmann I, Haan S, et al. Principles of interleukin (IL)-6-type cytokine signalling and its regulation. Biochem J 2003;374:1–20.
- Насонов Е.Л., Мазуров В.И., Усачева Ю.В. и др. Разработки отечественных оригинальных генно-инженерных биологических препаратов для лечения иммуновоспалительных ревматических заболеваний. Научно-практическая ревматология 2017;55(2):201-10 [Nasonov EL, Mazurov VI, Usacheva YuV, et al. Developments of Russian original biological agents for the treatment of immunoinflammatory rheumatic diseases. Nauchcno-Practicheskaya Revmatologia = Rheumatology Science and Practice 2017;55(2):201-10 (In Russ.)].
- Ассоциация ревматологов России. Ревматоидный артрит. Клинические рекомендации, 2021.
- Smolen JS, Landewe RBM, Bijlsma JWJ et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann Rheum Dis 2020;79;685-99.
- Мазуров В.И., Зоткин Е.Г., Гайдукова И.З. и др. Эффективность и безопасность применения левилимаба в комбинации с метотрексатом у пациентов с ревматоидным артритом: результаты II фазы исследования AURORA. Научно-практическая ревматология 2021;59(2):141–51 [Mazurov VI, Zotkin EG, Gaydukova IZ, et al. Efficacy and safety of levilimab in combination with methotrexate in subjects with rheumatoid arthritis: Results of phase II AURORA study. Nauchcno-Practicheskaya Revmatologia = Rheumatology Science and Practice 2021;59(2):141–51 (In Russ.)].
- Мазуров В.И., Королев М.А., Пристром А.М. и др. Эффективность и безопасность левилимаба в сочетании с метотрексатом при лечении пациентов с активным ревматоидным артритом, устойчивым к монотерапии метотрексатом (двойное слепое рандомизированное плацебо-контролируемое исследование III фазы, SOLAR). Современная ревматология 2021;15(4):13–23 [Mazurov VI, Korolev MA, Prystrom AM, et al. Effectiveness and safety of levilimab in combination with methotrexate in treatment of patients with active rheumatoid arthritis resistant to methotrexate monotherapy (double-blinded randomized placebo controlled phase III clinical study SOLAR). Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2021;15(4):13–23 (In Russ.)].
- Huizinga TW, Fleischmann RM, Jasson M, et al. Sarilumab, a fully human monoclonal antibody against IL-6Ra in patients with rheumatoid arthritis and an inadequate response to methotrexate: efficacy and safety results from the randomised SARIL-RA-MOBILITY Part A trial. Ann Rheum Dis 2014;73(9):1626-34.
- Kivitz A, Olech E, Borofsky M, et a. Subcutaneous tocilizumab versus placebo in combination with disease-modifying antirheumatic drugs in patients with rheumatoid arthritis. Arthritis Care Res (Hoboken) 2014;66(11):1653-61.
- Fraenkel L, Bathon J, England B et al. 2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Rheumatol 2021;73: 1108-23.
- Caplan L, Wolfe F, Russell AS, Michaud K. Corticosteroid use in rheumatoid arthritis: prevalence, predictors, correlates, and outcomes. J Rheumatol 2007;34(4):696-705.
- van Ouwerkerk L, Palmowski A, Nevins IS, et al. Systematic literature review of observational cohorts and clinical trials into the success rate of glucocorticoid discontinuation after their use as bridging therapy in patients with rheumatoid arthritis. Ann Rheum Dis 2022;81(7):937-43.
- Hua C, Buttgereit F, Combe B. Glucocorticoids in rheumatoid arthritis: current status and future studies. RMD Open 2020;6(1):e000536.
- Maasssen JM, Sobrin R, Bergstra SA, et al. Glucocorticoid discontinuation in patients with early rheumatoid and undifferentiated arthritis: a post-hoc analysis of the BeSt and IMPROVED studies. Ann Rheum Dis 2021;80(9):1124-9.
- Boers M, Hartman L, Opris-Belinski D, et al.Low dose, add-on prednisolone in patients with rheumatoid arthritis aged 65+: the pragmatic randomised, doubleblind placebo-controlled GLORIA trial. Ann Rheum Dis 2022;81:925-36.
- Choy E, Caporali R, Xavier R, et al. Effects of concomitant glucocorticoids in TOZURA, a common-framework study programme of subcutaneous tocilizumab in rheumatoid arthritis. Rheumatology (Oxford) 2019;58(6):1056-64.
- Burmester GR, Buitgereit F, Bernasconi C, et al. Continuing versus tapering glucocorticoids after achievement of low disease activity or remission in rheumatoid arthritis (SEMIRA): a double-blind, multicentre, randomised controlled trial. Lancet 2020;396:267-76.
- Nagy G, Roodenrijs NMT, Welsing PMJ, et al. EULAR points to consider for the management of difficult-to-treat rheumatoid arthritis. Ann Rheum Dis 2022;81(1):20-33.
- Dougados M, Kissel K, Sheeran T, et al. Adding tocilizumab or switching to tocilizumab monotherapy in methotrexate inadequate responders: 24-week symptomatic and structural results of a 2-year randomised controlled strategy trial in rheumatoid arthritis (ACT-RAY). Ann Rheum Dis 2013;72(1):43-50.
- Kaneko Y, Atsumi T, Tanaka Y, et al. Comparison of adding tocilizumab to methotrexate with switching to tocilizumab in patients with rheumatoid arthritis with inadequate response to methotrexate: 52-week results from a prospective, randomised, controlled study (SURPRISE study). Ann Rheum Dis 2016;75(11):1917-23.
- Sherbini AA, Sharma SD, Gwinnutt JM, et al. Prevalence and predictors of adverse events with methotrexate mono- and combination-therapy for rheumatoid arthritis: a systematic review. Rheumatology (Oxford) 2021;60(9):4001-17.
- Sherbini AA, Gwinnutt JM, Hyrich KL; RAMS Co-Investigators, Verstappen SMM. Rates and predictors of methotrexate-related adverse events in patients with early rheumatoid arthritis: results from a nationwide UK study. Rheumatology (Oxford) 2022;61(10):3930-8.
- Shea B, Swinden MV, Tanjong Ghogomu E, et al. Folic acid and folinic acid forreducing side effects in patients receiving methotrexate for rheumatoid arthritis. Cochrane Database Syst Rev 2013;2013(5):CD000951.
- Насонов Е.Л. Перспективы фармакотерапии ревматоидного артрита: новые возможности и рекомендации. Терапевтический архив 2016;12:4-10 [Nasonov EL. Prospects for rheumatoid arthritis pharmacotherapy: New opportunities and recommendations. Terapevticheskii Arkhiv 2016;12:4-10 (In Russ.)].
- Schiff MH, Jaffe JS, Freundlich B. Head-to-head, randomised, crossover study of oral versus subcutaneous methotrexate in patients with rheumatoid arthritis: drugexposure limitations of oral methotrexate at doses ≥15 mg may be overcome with subcutaneous administration. Ann Rheum Dis 2014;73(8):1549-51.
- Kremer JM, Rigby W, Singer NG, et al. Sustained response following discontinuation of methotrexate in patients with rheumatoid arthritis treated with subcutaneous tocilizumab: results from a randomized, controlled trial. Arthritis Rheumatol 2018;70(8):1200-8.
- Pappas DA, Blachley T, Zlotnick S, et al. Methotrexate discontinuation and dose decreases after therapy with tocilizumab: results from the Corrona Rheumatoid Arthritis Registry. Rheumatol Ther 2020;7(2):357-69.
