Ревматологические синдромы, вызываемые лекарствами
В статье рассматриваются реакции на различные лекарственные средства, напоминающие те или иные идиопатические ревматические заболевания и синдромы или не отличимые от них, в том числе лекарственная красная волчанка, гиперурикемия и подагра, остеопатия, поражение скелетных мышц (статины) и сухожилий (фторхинолоновые антибиотики), а также аутоиммунные и воспалительные синдромы, вызываемые ингибиторами иммунологических контрольных точек. Анализируются механизмы побочного действия отдельных лекарственных средств, приводятся рекомендации в отношении рациональной терапии осложнений.
Некоторые лекарственные реакции, напоминающие те или иные идиопатические ревматические заболевания и синдромы или не отличимые от них, известны давно, например, лекарственная красная волчанка и лекарственная подагра. С появлением новых препаратов возникает вероятность развития ранее неизвестных осложнений. Относительно недавно стали известны иммуноопосредуемые нарушения в виде различных ревматических заболеваний (ревматоидный артрит и др.), возникавших во время применения новых противоопухолевых препаратов – ингибиторов иммунологических контрольных точек (checkpoint inhibitors) [1]. С позиции клинического фармаколога обсуждаемые реакции, вряд ли, имеют существенное значение, так как они возникают преимущественно редко или очень редко. Для ревматолога же знание этих осложнений полезно и позволяет в ряде случаев существенно помочь больному, например избавить его от рецидивирующей подагры, индуцированной мочегонными препаратами. К ревматологу, скорее всего, будут обращаться и пациенты с метаболическими остеопатиями, развивающимися во время длительного лечения бисфосфонатами, статиновыми миопатиями и фторхинолоновыми тендинопатиями.
Лекарственная волчанка
В 90-х годах я заподозрил лекарственную красную волчанку у пожилой женщиныврача. Триада симптомов в виде плеврита, лейкопении и высокого титра антинуклеарных антител в сыворотке была предположительно связана с длительным приемом ингибитора ангиотензинпревращающего фермента периндоприла, который с эффектом применялся по поводу артериальной гипертонии. Пациентка не последовала моему совету отменить периндоприл, так как другие антигипертензивные препараты были неэффективными, и предпочла начать прием преднизолона в дозе 15 мг/сут. Плеврит и лейкопения быстро исчезли, но при попытках отмены преднизолона эти симптомы возобновлялись, а повышенный уровень ан ти нуклеарных антител сохранялся. Пример но через 1 год развилась тяжелая пневмония с летальным исходом.
Количество лекарственных препаратов разных фармакологических групп, вызывающих лекарственную красную волчанку (ЛКВ), со временем увеличивается и сегодня насчитывает несколько десятков. Изме няется и “удельный вес" отдельных препаратов в структуре причин ЛКВ. В настоящее время практически не применяются “классические" индукторы ЛКВ, такие как гидралазин, прокаинамид (новокаинамид), сульфаниламиды или b-ад реноблокаторы практолол и ацетобутолол, а на первый план вышли ингибиторы протонной помпы и генноинженерные биологические препараты (ГИБП), особенно ингибиторы фактора некроза опухоли-a (ФНО-α) [2].
Общепринятого определения ЛКВ нет. В диагностике существенное значение придается следующим обстоятельствам [3,4].
1. Возникновение клинических симптомов, характерных для хронической кожной (дискоидной), подострой кожной или идиопатической системной красной волчанки (СКВ), сопровождающихся повышением титра антинуклеарных антител (АНА) в сыворотке во время применения лекарственного препарата и исчезновением этих нарушений после его отмены. Бессимп томное повышение уровня АНА в качестве критерия ЛКВ не рассматривается, хотя может задолго предшествовать развитию клинических проявлений.
2. Развитие ЛКВ не сразу после начала лекарственной терапии, а обычно не ранее, чем через один месяц (нередко через 1 год и более). Системные лекарственные реакции, возникающие вскоре после начала терапии (например, нестероидными противовоспалительными препаратами, антибиотиками, эстрогенами), чаще указывают на обострение уже существующей СКВ. Примечательно, что препараты, вызывающие ЛКВ, к обострению СКВ, как правило, не приводят.
Лекарственные препараты, которые могут вызывать ЛКВ, подразделяют на группы с высоким, умеренным, низким и очень низким риском возникновения этого осложнения. Высокий риск развития ЛКВ, для которой характерны системные проявления, свойственен новокаинамиду (29%) [5] и гидралазину (6,7%) [6], умеренный – хинидину (<1%), изониазиду и сульфасалазину, низкий – хлорпромазину, метилдопе, каптоприлу, миноциклину, карбамазепину, пропилтиоурацилу, Dпеницилламину, сульфаниламидам и 5-аминосалициловой кислоте [3].
Наиболее частые клинические симптомы ЛКВ – артралгии, миалгии, серозит (плеврит, перикардит), легочные инфильтраты, лихорадка и общая слабость [3,7]. Обычно наблюдаются симметричные боли в мелких суставах, хотя могут отмечаться и боли в крупных суставах, а также артрит. Типичны кожная сыпь, обычно макулопапулезная, и фоточувствительность; описаны пурпура, ветвистое ливедо, узловатая эритема и язвы кожи. Эритема на скулах, типичная для идиопатической СКВ, возникает редко. Нередко встречаются небольшая анемия, лейкопения и тромбоцитопения. Классификационные критерии СКВ у больных ЛКВ обычно не выполняются. Выраженность системных симптомов при ЛКВ, как правило, менее значительна, чем при идиопатической форме болезни, а прогностически неблагоприятное поражение внутренних органов, в том числе почек и ЦНС, наблюдается крайне редко.
Существуют клинические варианты ЛКВ, для которых характерны преимущественно дерматологические изменения. Лекарственной подострой кожной волчанке свойственна фоточувствительная распространенная симметричная аннулярная или полициклическая нешелушащаяся сыпь на открытых участках тела. Иногда возникают буллезные изменения или изменения, напоминающие многоформную эритему. Системные (органные) проявления обычно отсутствуют. Эта кожная реакция чаще развивается при использовании противогрибкового препарата тербинафина, ингибиторов ФНО-a, противосудорожных средств и ингибиторов протонной помпы [8], а также описана у пациентов, принимавших блокаторы кальциевых каналов, b-адреноблокаторы (окспренолол, ацебутолол), ингибиторы АПФ, лефлуномид и доцетаксел [2,3]. У пациентов с лекарственно-индуцированной подострой кожной волчанкой помимо АНА обнаруживают антитела Ro/SSA (в 74% случаев), La/SSB (в 25%) и антигистоновые антитела (в 17%) [9]. Описаны множественные эпизоды клинически сходных реакций у одного пациента на лекарственные препараты разных групп, а также на различные средства из одной фармакологической группы. После отмены лекарства-индуктора сыпь проходит в среднем через 13 недель (от 2 недель до 1,5 лет) [9].
Лекарственная хроническая кожная волчанка характеризуется дискоидными изменениями на открытых участках кожи. Иногда развиваются похожие на крапивницу единичные или множественные эритематозные или фиолетовые бляшки с гладкой нешелушащейся поверхностью. Такие изменения кожи описаны при применении фторурацила, капецитабина, нестероидных противовоспалительных препаратов, пантопразола и ингибиторов ФНО-α [10,11].
При всех формах ЛКВ практически всегда обнаруживают повышенный титр АНА в сыворотке обычно гомогенного типа свечения. Типично наличие антигистоновых антител (чувствительность – 67%, специфичность – 95%). Антитела к нативной ДНК, Sm-антитела (характерные для идиопатической СКВ) и антитела к RNP (типичны для смешанного заболевания соединительной ткани) выявляют редко. Могут определяться антитела к цитоплазме нейтрофилов (АНЦА), чаще к миелопероксидазе [7].
Применение указанных выше лекарственных препаратов может привести к изолированному повышению титра АНА, которое не сопровождается клиническими проявлениями. Например, при длительном приеме прокаинамида (новокаинамида) повышенный титр АНА отмечается примерно у половины пациентов, клинически же выраженная ЛКВ наблюдается только примерно в половине этих случаев [12]. После отмены препарата, вызвавшего ЛКВ, повышенный титр АНА может сохраняться намного дольше, чем клинические симптомы.
Следует отметить и другие особенности ЛКВ. Этот синдром развивается в более позднем возрасте, чем идиопатическая СКВ, и почти одинаково часто у мужчин и женщин. Для некоторых лекарственных препаратов известна зависимость частоты возникновения ЛКВ от дозы. Так, при лечении гидралазином ЛКВ развивается реже, если доза препарата составляет менее 200 мг/сут [6]. Это объясняется тем, что фактором риска ЛКВ, вызванной гидралазином, является медленный тип ацетилирования, которое играет основную роль в метаболизме препаратов. У “быстрых ацетиляторов" риск гидралазиновой волчанки существенно снижается. Это также относится к ЛКВ, вызванной сульфасалазином [13]. В то же время частота ЛКВ при лечении прокаинамидом не зависит от типа ацетилирования, так как препарат преимущественно выводится почками.
Отмена препарата, вызвавшего ЛКВ, всегда приводит к стиханию клинических проявлений в течение нескольких недель, но полное их исчезновение может затягиваться на срок до одного года. Скорость выздоровления обычно соответствует остроте симптомов. В ряде случаев может потребоваться кратковременное применение глюкокортикостероидов внутрь в небольшой суточной дозе. Если ЛКВ затягивается, приходится назначать гидроксихлорохин или даже иммунодепрессанты. Если у пациента обнаруживается только повышенный титр АНА, а клинические проявления отсутствуют, то абсолютной необходимости в отмене лекарственного препарата, вызвавшего этот лабораторный феномен, нет. Если симптомы предполагаемой ЛКВ со временем не проходят, следует предполагать идиопатическую СКВ. Повторное назначение препарата, вызвавшего ЛКВ, как правило, приводит к быстрому рецидиву.
ЛКВ описана при использовании инфликсимаба, этанерцепта и адалимумаба, т.е. самых “старых" ингибиторов ФНО-α [2,14,15]. В клинических исследованиях это осложнение было зарегистрировано примерно у 0,5% пациентов. Симптомы были типичными для ЛКВ, отмечались примерно одинаково часто при использовании разных препаратов и не отличались у пациентов с различными заболеваниями (ревматоидный артрит или анкилозирующий спондилит). Наблюдались как системные нарушения (преимущественно мышечно-скелетные и общего характера), так и кожные изменения (сыпь на лице, фоточувствительность, подострые и хронические изменения). Прояв ления ЛКВ возникали отсрочено, в среднем примерно через год после начала лечения. В отдельных случаях определялись изменения почек. Нередко помимо АНА обнаруживали антитела к нативной (двуспиральной) ДНК и гипокомплементемию. Переход на другой ингибитор ФНО-α не всегда обеспечивал прекращение рецидивов ЛКВ, однако они возникали не всегда.
Лекарственные гиперурикемия и подагра
В табл. 1 перечислены лекарственные препараты, вызывающие повышение уровня мочевой кислоты (МК) в крови и иногда развитие приступа подагры. Лекар ственная гиперурикемия может быть связана с увеличением реабсорбции и/или снижением секреции МК в почках, реже – с увеличением ее синтеза.
| Препараты | Механизм, приводящий к гиперурикемии |
|---|---|
| Мочегонные средства | Увеличение реабсорбции и/или снижение секреции МК в почках. Уменьшение объема циркулирующей плазмы |
| АСК и другие салицилаты (≤300 мг/сут) | Увеличение реабсорбции и снижение секреции МК в почках |
| Цитотоксические средства | Массивное высвобождение МК вследствие разрушения нуклеиновых кислот в клетках. |
| Гиперурикемия развивается через 48-72 ч после начала терапии | |
| Циклоспорин | Увеличение реабсорбции МК в проксимальных канальцах почек |
| Пиразинамид, этамбутол | Увеличение реабсорбции и снижение секреции МК |
| Фруктоза (как сахарозаменитель) | Усиление метаболизма нуклеотидов |
| Тестостерон | Усиление реабсорбции МК в почках |
| Никотиновая кислота (3-6 г/сут) | Усиление реабсорбции и снижение секреции МК в почках |
Мочегонные средства. Риск развития подагры увеличивается при регулярном использовании большинства наиболее эффективных диуретиков: петлевых [сульфонамидных (фуросемид, буметанид, торасемид) и несульфонамидных (этакриновая кислота)], тиазидных (гидрохлоротиазид) и тиазидоподобных (индапамид, клопамид). Калийсберегающие мочегонные средства (амилорид и триамтерен) и антагонисты альдостерона не индуцируют приступы подагры, но у пациентов с хронической болезнью почек могут вызывать гиперурикемию [16,17].
Петлевые и тиазидные диуретики ингибируют транспортеры органических кислот ОАТ1 и ОАТ3, увеличивая реабсорбцию МК в проксимальных канальцах почек. Кроме того, лечение диуретиками приводит к потере солей и воды и уменьшению объема циркулирующей плазмы, что стимулирует реабсорбцию МК. Гиперурикемию чаще вызывают петлевые, а не тиазидные диуретики [16]. При сравнении двух тиазидных мочегонных препаратов хлорталидона и гидрохлоротиазида (в одинаковых дозах) у пациентов с артериальной гипертонией риск развития новых случаев подагры был одинаковым [18]. Повышение содержания МК по сравнению с исходным уровнем отмечается через несколько дней после начала лечения различными диуретиками, зависит от дозы препаратов и составляет по обобщенным данным нескольких двойных слепых плацебо-контролируемых исследований от 6% до 19% [18]. Гиперурикемия сохраняется при продолжении лечения, а уровень МК нормализуется через несколько месяцев после отмены диуретика [19].
Нужно учитывать, что артериальная гипертония сама по себе является фактором риска развития подагры, вероятно, вследствие снижения почечного кровотока и почечной экскреции уратов. У пациентов с артериальной гипертонией относительный риск развития подагры повышен почти в два раза по сравнению с таковым у лиц с нормальным АД (1,99; 95% доверительный интервал [ДИ] 1,92, 2,06) [20]. Уровень МК в сыворотке может повыситься под влиянием не только диуретиков, но и некоторых других антигипертензивных средств, в том числе b-адреноблокаторов, ингибиторов АПФ и блокаторов рецепторов ангиотензина II (кроме лозартана). В то же время антагонисты кальция не влияют на содержание МК в крови. В крупном популяционном исследовании, проведенном в Великобритании, оценивался относительный риск развития подагры у 29138 пациентов с артериальной гипертонией, принимавших различные антигипертензивные препараты [19]. Риск подагры не был повышен в случае приема лозартана (отношение шансов 0,81, 95% ДИ 0,70, 0,94) и блокаторов медленных кальциевых каналов (0,87; 95% ДИ 0,82, 0,93) и увеличен при лечении диуретиками (2,36; 95% ДИ 2,21, 2,52 ) и в меньшей степени b-адреноблокаторами (1,48; 95% ДИ 1,40, 1,57), ингибиторами АПФ (1,24; 95% ДИ 1,17, 1,32) и блокаторами рецепторов ангиотензина II (1,29; 95% ДИ 1,16, 1,43), кроме лозартана. Лозартан, в отличие от других блокаторов рецепторов ангиотензина II, оказывает урикозурическое действие и снижает уровень МК в сыворотке на 20-25% у здоровых людей, пациентов с артериальной гипертонией и пациентов с трансплантированной почкой. Антагонисты медленных кальциевых каналов могут увеличивать клубочковую фильтрацию и, соответственно, скорость клиренса МК [20].
В случае развития или обострения подагры у пациентов с артериальной гипертонией рекомендуется отменить диуретик или, по крайней мере, уменьшить его дозу (кратность приема), что в ряде случаев приводит к прекращению приступов артрита. Доза гидрохлоротиазида должна составлять, по возможности, не более 12,5 мг/сут. Целесообразна также попытка применения калийсберегающих диуретиков или антагонистов альдостерона. У пациентов с артериальной гипертонией и подагрой имеет смысл оптимизировать применение антигипертензивных средств, отдавая предпочтение блокаторам медленных кальциевых каналов и лозартану.
Ацетилсалициловая кислота (АСК). Примерно с конца 50-х годов прошлого века известно, что АСК (и другие салицилаты) в больших дозах (>3 г/сут) повышают выведение МК с мочой, а в более низких дозах (1-2 г/сут) задерживают ее выведение. Действие салицилатов на выведение МК, скорее всего, осуществляется через почечный транспортер URAT1. В высоких дозах АСК ингибирует URAT1 и оказывает урикозурическое действие, сходное с таковым урикозурических препаратов, например, пробенецида. Напротив, низкие дозы салицилатов вызывают стимуляцию URAT1. Caspi и соавт. показали, что АСК в дозах 75, 150 и 325 мг/сут через 1 неделю применения снижала экскрецию уратов в среднем на 1,35, 0,85 и 0,65 мл/мин, соответственно, и увеличивала уровни МК в сыворотке на 0,27, 0,21 и 0,04 мг/дл [21]. В исследовании, которое проводилось у пациентов с подагрой, наблюдавшихся в течение 1 года, осуществлялся анализ влияния применения АСК (как антиагрегантного средства) в дозах ≤325 мг/сут на частоту повторных приступов болезни. Установлено, что прием АСК в течение по крайней мере двух последовательных дней перед атакой подагры увеличивал риск ее возникновения на 81% по сравнению с пациентами, не принимавшими АСК. Риск обострения подагры был несколько выше при использовании АСК в дозе ≤100 мг/сут [22].
Отрицательное влияние низких доз АСК на уровень МК может нивелироваться аллопуринолом или пробенецидом. Но назначение этих препаратов пациентам с гиперурикемией, принимающих АСК, необязательно и зависит от реального влияния АСК на уровень МК у конкретного пациента. Если этот эффект определяется и имеет клиническое значение (развитие подагрического приступа), рекомендуется заменить АСК на другой блокатор агрегации тромбоцитов или антикоагулянт.
Циклоспорин, использующийся в настоящее время в основном для предотвращения реакции отторжения трансплантированных органов, усиливает реабсорбцию МК в проксимальных канальцах почек, что имеет особое значение для пациентов, принимающих диуретики, или при снижении функции почек. У пациентов с пересаженной почкой частота гиперурикемии варьирует от 19% до 55%. В случае применения циклоспорина она увеличивается до 30-84%, а частота подагры составляет 2-28% Подагрический артрит развивается через несколько месяцев после начала терапии. Наблюдается ускоренное формирование тофусов необычной локализации (мягкие ткани, позвоночник, крестцово-подвздошные сочленения) [23]. Другой ингибитор кальциневрина, такролимус, также увеличивает частоту гиперурикемии после трансплантации почки [24]. В случае острого приступа подагры у пациентов, принимающих циклоспорин, не следует использовать нестероидные противовоспалительные препараты из-за повышенного риска нефротоксичности, а колхицин необходимо применять с осторожностью. Предпочтение отдают глюкокортикостероидам. В качестве антиподагрического средства назначают фебуксостат. При наличии тофусов может быть полезен бензбромарон.
Циклоспорин, использующийся в настоящее время в основном для предотвращения реакции отторжения трансплантированных органов, усиливает реабсорбцию МК в проксимальных канальцах почек, что имеет особое значение для пациентов, принимающих диуретики, или при снижении функции почек. У пациентов с пересаженной почкой частота гиперурикемии варьирует от 19% до 55%. В случае применения циклоспорина она увеличивается до 30-84%, а частота подагры составляет 2-28% Подагрический артрит развивается через несколько месяцев после начала терапии. Наблюдается ускоренное формирование тофусов необычной локализации (мягкие ткани, позвоночник, крестцово-подвздошные сочленения) [23]. Другой ингибитор кальциневрина, такролимус, также увеличивает частоту гиперурикемии после трансплантации почки [24]. В случае острого приступа подагры у пациентов, принимающих циклоспорин, не следует использовать нестероидные противовоспалительные препараты из-за повышенного риска нефротоксичности, а колхицин необходимо применять с осторожностью. Предпочтение отдают глюкокортикостероидам. В качестве антиподагрического средства назначают фебуксостат. При наличии тофусов может быть полезен бензбромарон.
Цитотоксическая терапия. Цитотоксические противоопухолевые средства закономерно вызывают гиперурикемию вследствие разрушения нуклеиновых кислот клеток. В случае быстрого разрушения большой массы опухолевых клеток может развиться серьезное и прогностически неблагоприятное осложнение – синдром лизиса опухоли. Этот синдром чаще наблюдается у пациентов с лимфомой, острым лейкозом и другими быстро растущими опухолями в течение до 7 дней после начала терапии и характеризуется лабораторными метаболическими нарушениями (гиперурикемия, гиперкалиемия, гиперфосфатемия, гипокальциемия и метаболический ацидоз) и клиническими проявлениями (острое почечное повреждение, аритмии, судороги).
Острое почечное повреждение преимущественно обусловлено обструкцией мочевыводящих путей кристаллами уратов. Смертность (от полиорганной недостаточности) составляет 20-50%. Синдром лизиса опухоли может развиться при применении не только цитотоксических противоопухолевых препаратов, но и дексаметазона в больших дозах, ритуксимаба, золендроновой кислоты и ряда новых противоопухолевых ГИБП.
Для профилактики синдрома лизиса опухоли важное значение имеют мониторирование уровней МК, калия и фосфора в крови, показателей функции почек и диуреза и профилактическое назначение аллопуринола. Лечение заключается во внутривенной гидратации с ежедневным введением 2500-3000 мл жидкости, применении фуросемида, аллопуринола или разбуриказы, а при развитии гиперкалиемии – гемодиализа.
Для профилактики синдрома лизиса опухоли важное значение имеют мониторирование уровней МК, калия и фосфора в крови, показателей функции почек и диуреза и профилактическое назначение аллопуринола. Лечение заключается во внутривенной гидратации с ежедневным введением 2500-3000 мл жидкости, применении фуросемида, аллопуринола или разбуриказы, а при развитии гиперкалиемии – гемодиализа.
Фруктоза – единственный заменитель пищевой глюкозы, который после парентерального введения и приема внутрь повышает уровень МК в крови и моче за счет усиления синтеза пуриновых оснований нуклеотидов. Этот эффект зависит от дозы. В одном исследовании применение диеты с высоким содержанием фруктозы (250-290 г/сут) приводило у здоровых (без подагры и гиперурикемии) мужчин-добровольцев к повышению уровня МК в крови примерно на 1 мг/дл и суточной урикозурии примерно на 100 мг. Диета с высоким содержанием глюкозы не оказывала существенного влияния ни на урикемию, ни на урикозозурию [25]. Пациентам с подагрой рекомендуется избегать применения фруктозы, особенно в больших дозах.
Тестостерон. Заместительная терапия тестостероном (например, в целях изменения пола) повышает уровень МК в зависимости от дозы. Частота развития гиперурикемии (≥7,0 мг/дл) через 3 мес после начала лечения тестостерона энантатом в дозе 125 мг каждые две недели составила 5%, а в дозе 250 мг – 14,8% [26].
Гиперурикемия описана также при применении ацитретина, диданозина и ритонавира, филграстима, леводопы, омепразола, пегилированного интерферо наa в комбинации с рибавирином, силденафила, терипаратида, тикагрелола, топирамата, рибоксина [27].
Лекарственная остеопатия
Лекарственные препараты могут оказывать отрицательное действие на костную ткань различным образом. Чаще это происходит вследствие прямого угнетения костеобразования (типичный пример – глюкокортикостероиды) или усиления костной резорбции, что приводит к снижению минеральной костной плотности (МПК) и развитию остеопороза с учащением переломов. Но возможно и опосредованное воздействие, обусловленное нарушениями метаболизма различных компонентов костной ткани (кальция, фосфора) или их регуляторов (витамина D, эстрогенов, паратгормона и др.) с возникновением различных вариантов костной патологии (остеопороз, остеомаляция, остеодистрофия).
Препараты, оказывающие прямое отрицательное действие на костную ткань. Самыми известными лекарственными препаратами, вызывающими снижение массы костной ткани и повышающими риск переломов, являются глюкокортикостероиды. Проблема стероидного остеопороза и способы ее решения подробно описаны в специальной литературе, поэтому в статье этот вопрос не рассматривается.
Кроме того, возможность развития остеопороза предполагается или твердо установлена при лечении ингибиторами протонной помпы, селективными ингибитора серотонина и препаратами, угнетающие синтез эстрогенов.
Ингибиторы протонной помпы. Повышение частоты переломов шейки бедренной кости, позвоночника и костей предплечья было отмечено в нескольких эпидемиологических исследованиях этих препаратов. Риск переломов увеличивался у престарелых пациентов в случае применения более высоких доз препаратов в течение более длительного времени [28]. Однако в одном исследовании у пациентов, у которых отсутствовали основные факторы риска остеопороза, связь между применением ингибиторов протонной помпы и переломами выявить не удалось [29]. В настоящее время доказательная база в отношении отрицательного действия этих противоязвенных средств на костную ткань признается недостаточной. Также противоречивы данные об ухудшении всасывания кальция вследствие снижения продукции желудочного сока – предполагаемом механизме отрицательного действия на кость ингибиторов протонной помпы. Поэтому каких-либо специальных ограничений в официальных инструкциях по применению омепразола или других ингибиторов желудочной секреции не содержится, но в разделе о мерах предосторожности указывается, что необходимо мониторирование МПК с помощью остеоденситометрии у пациентов, получающих большие дозы препаратов или длительную терапию (≥1 года). В тех случаях, когда у пациента имеются дополнительные факторы риска остеопороза, следует использовать минимальные эффективные дозы ингибиторов протонной помпы, сокращать длительность терапии, одновременно применять кальций и витамин D и придерживаться других известных рекомендаций в отношении снижения риска переломов. Предпочти тельно применение кальция цитрата (а не карбоната, как обычно), для всасывания которого не требуется кислое микроокружение [30]. У пациентов с множественными факторами риска остеопороза целесообразно рассмотреть вопрос о замене блокаторов протонной помпы другими противоязвенными средствами, не оказывающими отрицательного влияния на костную ткань (например, блокаторы Н2-гистаминовых рецепторов).
Антидепрессанты. Селективные ингибиторы обратного захвата серотонина блокируют транспортер серотонина, который способствует входу этого медиатора в клетку из внеклеточного матрикса. Транспортер серотонина имеется во всех главных типах костных клеток. В экспериментах у молодых животных (в период роста) показано, что селективные ингибиторы обратного захвата серотонина снижают накопление минерализованной кости, а у мышей с отсутствием гена транспортера серотонина уменьшают массу костной ткани и нарушают ее архитектонику, что приводит к ухудшению механических свойств кости [31].
В одном из крупных проспективных исследований, в котором участвовали 5008 пациентов в возрасте 50 лет и более, было установлено, что ежедневное применение селективных ингибиторов обратного захвата серотонина в течение 5 лет в два раза увеличивало риск переломов, возникавших после минимальной травмы, а также приводило к достоверно более выраженному снижению МПК в бедренной кости и позвоночнике (это была лишь тенденция) по сравнению с таковым у лиц, не принимавших антидепрессанты. Нужно отметить, что помимо отрицательного влияния на костную ткань, при лечении антидепрессантами было отмечено достоверное учащение падений [32]. Пока официальных рекомендаций в отношении особенностей применения этих препаратов у пациентов с остеопорозом не предложено, однако следует учитывать возможный негативный остеотропный потенциал антидепрессантов данной группы при наличии других факторов риска.
Тиазолидиндионы (росиглитазон), применяющиеся у пациентов с сахарным диабетом 2 типа, в экспериментах у животных оказывали отрицательное действие на костную ткань. Существуют предварительные данные об учащении переломов у пациентов, получавших тиазолидиндионы, но полноценные исследования пока не проводились [33].
Препараты, снижающие уровень эстрогенов. Суще ствует три группы лекарственных средств, вызывающих дефицит эстрогенов, что приводит к ускорению метаболизма костной ткани и удлинению фазы резорбции вследствие замедления апоптоза остеокластов: агонисты гонадотропин-рилизинг гормона, ингибиторы ароматазы и медроксипрогестерона ацетат. Агонисты гонадотропин-рилизинг гормона снижают уровни лютеинизирующего и фолликулостимулирующего гормонов, что, в свою очередь, подавляет синтез эстрогенов в яичниках и синтез андрогенов в яичках. Эти препараты у мужчин применяются для лечения рака предстательной железы, а у женщин – для лечения эндометриоза и ряда других заболеваний. В случае длительной терапии они снижают массу костной ткани и повышают риск переломов. Агонисты гонадотропинрилизинг гормона следует применять с осторожностью у пациентов с уже имеющимся остеопорозом или факторами риска его развития.
Летрозол и другие ингибиторы ароматазы, применяющиеся для лечения рака молочной железы, снижают уровень эстрогенов и, благодаря этому, вызывают снижение МПК и повышение риска переломов. Перед началом терапии рекомендуется определять МПК в различных отделах скелета и применять антиостеопоротические средства даже при наличии только остеопении.
Медроксипрогестерона ацетат в случае длительного применения в качестве контрацептивного средства снижает уровень эстрогенов и повышает скорость потери костной ткани. Это отрицательное влияние на метаболизм костной ткани послужило основанием для рекомендации о длительном использовании препарата (в течение более 2 лет) только в случае невозможности применения других методов контрацепции. Перед длительным применением этого препарата рекомендуется измерение МПК.
Бисфосфонаты при длительном (более 3-5 лет) применении могут приводить к развитию так называемых атипичных (нетравматических) переломов бедренных костей. Это осложнение возникает редко, не более, чем у 0,1% пациентов. Обычно переломы локализуются в субтрохантерных отделах (иногда с обеих сторон), реже – в диафизе бедренной кости. Иногда развитию перелома предшествует боль в этих областях. Факторами риска считают монголоидную расу, гипофосфатемию, активный ревматоидный артрит, применение глюкокортикостероидов более 6 месяцев, низкий уровень 25-гидроксивитамина D в крови.
Препараты, оказывающие опосредованное отрицательное системное влияние на костную ткань. Противо судо рожные средства. У пациентов с эпилепсией повышена частота переломов, даже если не проводится лечение антиконвульсантами. При длительном же применения этих препаратов снижается МПК и учащаются переломы. Считается, что возможно развитие не только остеопороза, но и нарушений минерализации кости (остеомаляция) или смешанных изменений (“поромаляция") вследствие дефицита витамина D. Отри ца тельное остеотропное действие свойственно фенитоину, примидону, фенобарбиталу и карбамазепину. Перед началом их применения и в процессе лечения рекомендуется проведение остеоденситометрии и определение уровня витамина D в крови. В случае выявления нарушений применяется соответствующая остеотропная терапия.
Препараты, вызывающие гипофосфатемию. Суще ству ют лекарственные средства, которые могут оказывать токсическое действие на проксимальные канальцы почек и вызывать полный или частичный синдром Фанкони – снижение реабсорбции ряда веществ с уменьшением их содержания в крови. Одно из наиболее значимых клинических проявлений синдрома Фанкони – гипофосфатемия с развитием остемаляции. К таким препаратам относятся противоопухолевые средства, содержащие платину (цисплатин), алкилирующие средства (ифосфамид), некоторые противовирусные средства (нуклеозидные ингибиторы обратной транскриптазы – тенофовир, использующийся для лечения ВИЧ-инфекции и гепатита В), вальпроат натрия (противосудорожный препарат) и аминогликозидные антибиотики (гентамицин, тобрамицин, амикацин). Подобные осложнения также свойственны салицилатам, сурамину (противопаразитарному средству), тетрациклиновым антибиотикам, ингибиторам тирозинкиназы, используемым в лечении гематологических опухолей. Помимо гипофосфатемии при синдроме Фанкони возможны аминоацидурия, протеинурия, метаболический ацидоз, глюкозурия (нормогликемическая), гипоурикемия, гипокалиемия и полиурия.
Обычные показатели, которые применяют для оценки глобальной функции почек (скорость клубочковой фильтрации и отношение альбумина/креатинина в моче), не способны выявить данный канальцевый дефект. Для оценки канальцевых нарушений определяют тубулярную протеинурию (ретинол-связывающий протеин и b2-микроглобулин), экскрецию фосфора [(фосфор в моче × креатинин в плазме × 100) / (фосфор в плазме × креатинин в моче)] или канальцевую максимальную реабсорбцию фосфатов (TmP) по отношению к скорости клубочковой фильтрации (CKФ) [TmP/СКФ = фосфор в плазме – (фосфор в моче × креатинин в плазме/креатинин в моче)]. Также целесообразно определение уровня фосфора и активности щелочной фосфатазы в крови. Для контроля за развитием нефротоксичности при использовании указанных выше препаратов рекомендуется регулярное определение фосфора в крови, показателя TmP/СКФ, глюкозурии и протеинурии, а также креатинина и уровня магния в крови (при использовании цисплатина или карбоплатина – каждые 6 мес, ифостамида – каждый год, а тенофовира – каждые 4 недели в первый год, а затем каждые 3 месяца).
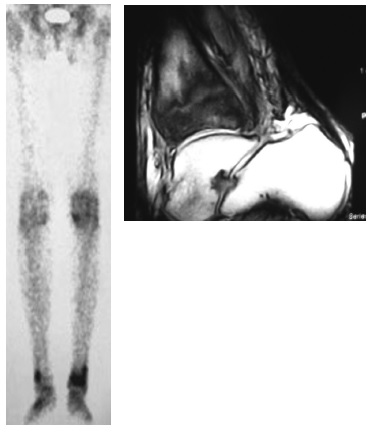
Метотрексат. Во время длительного применения метотрексата, например, у пациентов с ревматоидным артритом, в редких случаях возможно развитие стресспереломов. На рисунке приводятся данные визуализации стресс-переломов костей нижней трети голеней, развившихся у 69-летней пациентки с ревматоидным артритом, длительное время принимавшей метотрексат (рис. 1). Клиническими проявлениями были выраженные боли в голенях (вне суставов) в покое, усиливавшиеся при ходьбе и резко затруднявшие передвижение.
Остеопатия, вызванная метотрексатом, была впервые описана в 1984 г. у детей с острым лейкозом, длительно получавших этот препарат внутрь. В последующем стресс-переломы дистальных отделов костей голени и, реже, других костей нижних конечностей были зарегистрированы у отдельных пациентов с различными воспалительными ревматическими заболеваниями, принимавших метотрексат. Большинство пациентов были женщинами пожилого возраста, многие ранее принимали глюкокортикостероиды в небольших дозах, более чем у половины отмечался остеопороз шейки бедренной кости/или позвоночника по данным денситометрии, у части пациентов были повышены уровни костной щелочной фосфатазы в крови и деоксипиридинолина в моче. Метотрексат применялся в обычных дозах (15-25 мг в неделю). Отмена метотрексата и применение деносумаба и терипаратида приводили к постепенному заживлению переломов [34].
Препараты, вызывающие остеонекроз челюсти. Неко торые лекарственные средства могут вызывать некроз верхней или нижней челюсти. Первоначально (в 2003 г.) эти осложнения были описаны исключительно у онкологических пациентов, получавших бисфосфонаты парентерально (преимущественно памидронат и золендронат) с антирезорбционной целью. По данным нескольких рандомизированных плацебо-контроли руемых исследований, частота некроза челюстей у пациентов с опухолями, получавших внутривенно золендронат, составляла от 0,3% до 5% [35]. Деструк тивные (некротические) изменения различных размеров нижней или верхней челюсти возникали после хирургических малоинвазивных стоматологических вмешательств, таких как экстракция зуба или установка имплантов, на фоне заболеваний периоста или даже без местных воздействий. Наблюдались труднозаживающие изменения с обнажением кости, секвестрами и/или остеолизом. Метастазы в этих зонах отсутствовали, местная лучевая терапия не проводилась. Лечение было малоэффективным, нередко отмечались присоединение инфекции и инвалидизирующие последствия. Остео некроз другой локализации не описан.
Позднее выяснилось, что остеонекроз челюстей может развиться и в ходе лечения бисфосфонатами системного остеопороза, причем не только после парентерального, но и перорального их применения, хотя частота этого осложнения была заметно ниже (0,01-0,02%), чем у онкологических пациентов. Среди пероральных бисфосфонатов риск остеонекроза самый низкий при лечении этидронатом и выше – алендронатом и резидронатом. Развитие некроза челюстей может наблюдаться при использовании не только бисфосфонатов, но и деносумаба (моноклональное антитело к лиганду RANK), применявшегося парентерально для лечения системного остеопороза и костных метастазов (риск 0,7-1,9%). Подобные изменения были описаны и при использовании ингибиторов ангиогенеза (бе ва цизумаба и др.), применяющихся в терапии злокачественных опухолей. Поэтому первоначально использовавшийся термин “остеонекроз челюсти, вызываемый бисфосфонатами" (bisphosphonate-related osteonecrosis of the jaw, BRONJ), был в последнее время заменен на термин “лекарственный остеонекроз челюсти" (medication-related osteonecrosis of the jaw, MRONJ).
Для профилактики остеонекроза челюстей рекомендуется тщательная санация полости рта и проведение необходимых стоматологических процедур до начала терапии бисфосфонатами и деносумабом, отмена этих лекарственных средств за 2 месяца до хирургических стоматологических вмешательств, а также “каникулы" (приостановка терапии) для алендроната, резидроната или ибандроната каждые 5 лет, для золендроната – каждые 3 года. Эффективное лечение лекарственного остеонекроза не разработано, рекомендуются отмена соответствующего препарата, локальные консервативные средства (антисептики, антибиотики) и хирургические методы (удаление секвестров), гипербарическая оксигенация.
Патология скелетных мышц, вызываемая статинами
Этим термином обозначают различные изменения скелетных мышц, которые могут возникнуть у пациентов, принимающих статины. Мышечные изменения в этих случаях принято подразделять на неосложненные миалгии, миопатию, миозит и мионекроз (включая рабдомиолиз).
Неосложненные миалгии не сопровождаются объективными признаками мышечной слабости и повышением активности креатинфосфокиназы (КФК). В плацебо-контролируемых исследованиях неосложненные миалгии отмечались у 9,4% (у 3551 из 37939) пациентов, примерно также часто, как и в случае применения плацебо [36], однако в исследованиях наблюдательного типа частота болей в мышцах достигала 20% [37]. Боли в мышцах возникают преимущественно в плечевом и тазовом поясе, они симметричны, появляются во время или после физической нагрузки, могут сопровождаться крампи и локальной болезненностью при пальпации. Боли в мышцах обычно проходят после отмены статинов (в пределах 6 недель), но возобновляются после повторного применения этих препаратов. Миопатия, помимо болей, характеризуется мышечной слабостью и нормальной или немного повышенной активностью КФК. Усиливать проявления статиновой миопатии может одновременный прием фибратов и ингибиторов цитохрома Р450 (эритромицина, кларитромицина, циклоспорина, клопидогрела, телапревира – ингибитора протеазы вируса гепатита С, ингибиторов протеазы ВИЧ, итраконазола, колхицина).
Для миозита характерна генерализованная мышечная слабость, иногда сопровождающаяся дисфагией. Миал гии могут отсутствовать. Всегда повышена активность КФК, которая обычно более чем в 10 раз превышает верхнюю границу нормы. Наблюдаются типичные для миозита электромиографические нарушения и морфологические изменения в биоптатах мышц. Описаны различные варианты генерализованного миозита: полимиозит, дерматомиозит, иммуноопосредуемая некротическая миопатия, которые сохраняются после отмены статинов и требуют серьезного лечения, аналогичного терапии идиопатического полимиозита. Анализ объединенных данных 49 исследований аторвастатина у 14236 пациентов (длительность лечения составляла от 2 недель до 52 мес) показал, что частота серьезной патологии мышц (клинические симптомы + повышение КФК более чем в 10 раз по сравнению с верхней границей нормы) составляла в случае применения препарата в дозе 10 мг/сут 0,21%, а в дозе 80 мг/сут – 0,47% [38]. Если одновременно обнаруживается миоглобинурия и/или повышение концентрации креатинина в крови (>0,5 мг/дл), устанавливается диагноз рабдомиолиза. Частота рабдомиолиза составляет 1 на 100000 пациентов в год [39].
Изменения скелетных мышц развиваются обычно в течение первого месяца лечения статинами, иногда уже с первого дня терапии и редко – через несколько месяцев. Они могут наблюдаться при лечении любыми статинами, но чаще вызываются аторвастином и розувастатином, обладающими наибольшей эффективностью в отношении ингибирования ГМГ-КоА редуктазы, реже – правастатином, симвастатином, ловастином, флувастатином и питавастатином. Частота статиновой миопатии зависит от дозы.
В связи с высокой клинической значимостью статинов в лечении дислипидемий и отсутствием адекватной альтернативы решение о прекращении приема этих препаратов должно приниматься взвешенно. Если у пациента, принимающего статины, развиваются боли в скелетных мышцах, необходимо проанализировать возможную связь их с лечением, определить активность КФК, оценить возможность других причин болей и, наконец, определить эффект временной отмены и повторного применения подозреваемого препарата. Если мышечные симптомы сохраняются в течение более 2 месяцев после отмены статина, целесообразно провести поиск других объяснений этих симптомов.
Упорные неосложненные миалгии обычно вынуждают отменять статины. После прекращения болей и нормализации активности КФК можно попытаться возобновить прием препарата в той же или меньшей дозе.
Если мышечные симптомы возобновляются, данный статин отменяют окончательно. После исчезновения клинико-лабораторных изменений может быть назначен другой статин (сначала в небольшой дозе). Затем повышают его дозу до достижения требуемого эффекта в отношении уровня холестерина. Некоторые авторы рекомендует применение витамина D (50000-100000 МЕ в неделю) или убихинона (коэнзим Q10) для устранения статиновых болей в скелетных мышцах, но адекватные исследования этих препаратов не проводились.
Помимо мышечной патологии статины могут вызывать изменения сухожилий (тендинопатия). Они возникают в среднем через 8-10 месяцев после начала лечения и характеризуются болями при определенных движениях, чувством скованности, иногда локальной отечностью и гипертермией. Более чем у 50% пациентов отмечаются симптомы (нередко двухсторонние) повреждения ахиллового сухожилия, но возможна тендинопатия четырехглавой мышцы бедра, ягодичных мышц, сухожилий вращающей манжеты плеча.
Патология сухожилий, вызываемая фторхинолоновыми антибиотиками
Фторхинолоновые антибиотики (ципрофлоксацин, норфлоксацин, левофлоксацин и моксифлоксацин) могут вызывать изменения сухожилий дегенеративного характера (тендинопатия), приводящие к надрывам (с реактивным воспалением) и разрывам. Именно эти осложнения послужили основанием для ограничения использования фторхинолонов и их применения при нетяжелых инфекциях верхних дыхательных и мочевыводящих путей, когда нет альтернативного лечения. Фторхинолоновые антибиотики не рекомендуется применять в спортивной медицине [40]. Частота фторхинолоновой тендинопатии и разрывов сухожилий составляет по обзорным данным, соответственно, 4,97% и 2,85% [41].
Чаще всего (в 90% случаев) изменения возникают в пяточном (ахилловом) сухожилии, причем у половины пациентов с двух сторон. Известны случаи поражения и других сухожилий: двуглавой мышцы плеча, надостной мышцы, длинного разгибателя большого пальца кисти, четырехглавой мышцы бедра и др. Тендинопатия развивается остро, чаще через нескольких дней после начала лечения, иногда даже после приема первой дозы. Возникают боль и отечность сухожилия, при пальпации определяются местная болезненность, припухлость, гипертермия и иногда гиперемия. Примерно у 40% пациентов с поражением ахилловых сухожилий возникает их разрыв, иногда без боли. Разрыв сухожилия происходит через несколько дней после приема первой дозы препарата, но может возникать и отсрочено, через несколько недель после прекращения лечения. Риск патологии сухожилий увеличивается с возрастом пациентов (>60 лет), при наличии ожирения и в случае одновременного применения глюкокортикостероидов.
В пораженных сухожилиях наблюдаются дегенеративные изменения, микротрещины, интерстициальный отек без клеточной инфильтрации, а также участки некроза и неоваскуляризация. Предполагается, что изменения сухожилий, вызываемые фторхинолонами, обусловлены их негативным действием на теносиновиоциты и метаболизм коллагена.
Появление первых признаков тендинопатии должно быть поводом для незамедлительной отмены фторхинолоновых антибиотиков и использования ортезов с целью иммобилизации пораженного сегмента конечности. Местное использование глюкокортикостероидов противопоказано. У большинства пациентов симптомы тендинопатии проходят в течение 2 месяцев после отмены фторхинолоновых антибиотиков. Прогноз не всегда благоприятный в случае разрыва сухожилия (может потребоваться хирургическая реконструкция).
Аутоиммунные и воспалительные синдромы, вызываемые моноклональными антителами, блокирующими иммунологические контрольные точки (checkpoint inhibitors)
Эти биологические препараты, успешно применяющиеся для иммунотерапии многих злокачественных опухолей, ингибируют механизмы регуляции иммунного ответа (иммунологические контрольные точки), в частности блокируют торможение противоопухолевого иммунного ответа. Существуют моноклональные антитела, блокирующие ряд антигенов цитотоксических Тлимфоцитов: CTLA-4 (протеин-4, ассоциированный с цитотоксическими Т-лимфоцитами) – ипилимумаб, PD-1 (протеин-1 программированной клеточной смерти) – пембролизумаб, ниволумаб и PDL-1 (лиганд-1 программированной клеточной смерти) – атезолимумаб, авелумаб и дурвалумаб.
Применение этих лекарственных средств характеризуется, наряду со значительной противоопухолевой эффективностью, выраженной и разнонаправленной токсичностью, а также развитием аутоиммунных реакций. Среди последних преимущественно (примерно у 10% пациентов) наблюдались мышечно-скелетные реакции [42], артралгии (9-12%), а также артрит, в том числе симметричный полиартрит с вовлечением как мелких суставов кистей, так и крупных суставов, напоминающий ревматоидный артрит, в том числе серопозитивный [43]. Кроме того, описаны синдром, напоминающий ревматическую полимиалгию (комбинация болей в плечевом, тазовом поясе и шее), не сопровождающийся признаками гигантоклеточного артериита, ксеростомия, миозит, характеризовавшийся про ксимальной мышечной слабостью, дисфункцией диафрагмы, дисфагией, диплопией и типичными электромиографическими изменениями. Сообщалось и о единичных случаях системного васкулита и системной красной волчанки [44].
Степень выраженности аутоиммунных ревматологических реакций может быть различной, в том числе значительной. Они могут начинаться в различные сроки после начала иммунотерапии (от 2 до 48 недель). Часто требуется приостановка лечения и применение глюкокортикостероидов, а у части пациентов и других лекарственных средств, например, гидроксихлорохина, ингибиторов ФНО-a, внутривенного введения иммуноглобулина. Почти всегда аутоиммунные реакции хорошо поддаются дополнительной терапии и проходят в течение 6-12 недель.
Используемые источники
- Cappelli L, Bingham C. 3rd. Expert perspective: Immune checkpoint Inhibitors and rheumatologic complications. Arthritis Rheumatol 2021;73(4):553-65.
- He Y, Sawalha A. Drug-induced lupus erythematosus: an update on drugs and mechanisms. Curr Opin Rheumatol 2018;30(5):490-7.
- Pretel M, Marquès L, España A. Drug-induced lupus erythematosus. Actas Dermosifiliogr 2014;105(1):18-30.
- Клюквина Н.Г., Гунчикова В.М., Новикова А.М. Синдром лекарственной волчанки. Современная ревматология 2018;12(4):32–41.
- Henningsen N, Cederberg A, Hanson A, Johansson B. Effects of long-term treatment with procaine amide. A prospective study with special regard to ANF and SLE in fast and slow acetylators. Acta Med Scand 1975;198(6):475-82.
- Cameron H, Ramsay L. The lupus syndrome induced by hydralazine: a common complication with low dose therapy. Br Med J (Clin Res Ed) 1984;289(6442):410-12.
- Uetrecht J. Drug-induced lupus erythematosus. In: Kuhn A, Lehmann P, Ruzicka T, editors. Cutaneous lupus erythematosus. Berlin: Springer; 2005. P. 117-32.
- Grönhagen C, Fored C, Linder M et al. Subacute cutaneous lupus erythematosus and its association with drugs: a population-based matched case-control study of 234 patients in Sweden. Br J Dermatol 2012;167(2):296-305.
- Laurinaviciene R, Sandholdt L, Bygum A. Drug-induced cutaneous lupus erythematosus: 88 new cases. Eur J Dermatol 2017;27(1):28-33.
- Cohen P. Discoid lupus erythematosus lesions associated with systemic fluorouracil agents: a case report and review. Cureus 2020;12(4):e7828.
- Dalle V, Simon J, Girolomoni G. Drug-induced lupus erythematosus with emphasis on skin manifestations and the role of anti-TNFa agents. J Dtsch Dermatol Ges 2012;10(12):889-97.
- Henningsen N, Cederberg A, Hanson A, Johansson B. Effects of long-term treatment with procaine amide. A prospective study with special regard to ANF and SLE in fast and slow acetylators. Acta Med Scand 1975;198(6):475-82.
- Gunnarsson I, Kanerud L, Pettersson E et al. Predisposing factors in sulphasalazine-induced systemic lupus erythematosus. Br J Rheumatol 1997;36(10):1089-94.
- Yen C, Yu S, Chen Y et al. Mechanisms of tumor necrosis factor-alpha inhibitorinduced systemic lupus erythematosus. Front Med (Lausanne) 2022;9:870724.
- De Bandt M, Sibilia J, Le Loët X et al. Systemic lupus erythematosus induced by anti-tumour necrosis factor alpha therapy: a French national survey. Arthritis Res Ther 2005;7(3):R545-51.
- Bruderer S, Bodmer M, Jick S, Meier CR. Use of diuretics and risk of incident gout: a population-based case-control study. Arthritis Rheumatol 2014;66:185-96.
- Cabrera S, Edwards N, Steeds R. et al. Spironolactone increases serum uric acid levels in patients with chronic kidney disease. J Hum Hypertens 2014;28:210-11.
- Wilson L, Nair K, Saseen J. Comparison of new-onset gout in adults prescribed chlorthalidone vs. hydrochlorothiazide for hypertension. J Clin Hypertens (Greenwich) 2014;16(12):864-8.
- Reyes A. Cardiovascular drugs and serum uric acid. Cardiovasc Drugs Ther 2003;17(5-6):397-414.
- Choi H, Soriano L, Zhang Y, Rodríguez L. Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study. BMJ 2012;344:d8190.
- Caspi D, Lubart E, Graff E. et al. The effect of mini-dose aspirin on renal function and uric acid handling in elderly patients. Arthritis Rheum 2000;43(1):103-8.
- Zhang Y, Neogi T, Chen C. et al. Low-dose aspirin use and recurrent gout attacks. Ann Rheum Dis 2014;73(2):385-90.
- Clive D. Renal transplant-associated hyperuricemia and gout. J Am Soc Nephrol 2000;11(5):974-979.
- Van Thiel D, Iqbal M, Jain A. et al. Gastrointestinal and metabolic problems associated with immunosuppression with either CyA or FK 506 in liver transplantation. Transplant Proc 1990;22(1):37-40.
- Emmerson B. Effect of oral fructose on urate production. Ann Rheum Dis 1974;33(3):276-80.
- Pui K, Waddell C, Dalbeth N. Early onset of hyperuricaemia and gout following treatment for female to male gender reassignment. Rheumatology (Oxford) 2008;47(12):1840-1.
- Ben Salem C, Slim R, Fathallah N, Hmouda H. Drug-induced hyperuricaemia and gout. Rheumatology (Oxford) 2017;56(5):679-688.
- Hant F, Bolster M. Drugs that may harm bone: mitigating the risk. Cleve Clin J Med 2016;83(4):281-8.
- Kaye J, Jick H. Proton pump inhibitor use and risk of hip fractures in patients without major risk factors. Pharmacotherapy 2008;28(8):951-9.
- Straub D. Calcium supplementation in clinical practice: a review of forms, doses, and indications. Nutr Clin Pract 2007;22(3):286-96.
- Warden S, Haney E. Skeletal effects of serotonin (5-hydroxytryptamine) transporter inhibition: evidence from in vitro and animal-based studies. J Musculoskelet Neuronal Interact 2008;8(2):121-32.
- Richards J, Papaioannou A, Adachi J. et al.; Canadian Multicentre Osteoporosis Study Research Group. Effect of selective serotonin reuptake inhibitors on the risk of fracture. Arch Intern Med 2007;167(2):188-94.
- Zhang Y, Zheng Y, Yuan Y. et al. Effects of anti-diabetic drugs on fracture risk: a systematic review and network meta-analysis. Front Endocrinol (Lausanne) 2021;12:735824.
- Rolvien T, Jandl N, StЯrznickel J. et al. Clinical and radiological characterization of patients with immobilizing and progressive stress fractures in methotrexate osteopathy. Calcif Tissue Int 2021;108(2):219-30.
- Beth-Tasdogan N, Mayer B, Hussein H, Zolk O. Interventions for managing medication-related osteonecrosis of the jaw. Cochrane Database Syst Rev 2017;10(10):CD012432.
- Taylor F, Huffman M, Macedo A. et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev 2013;2013(1):CD004816.
- Selva-O'Callaghan A, Alvarado-Cardenas M, Pinal-Fernandez I, et al. Statininduced myalgia and myositis: an update on pathogenesis and clinical recommendations. Expert Rev Clin Immunol 2018;14(3):215-24.
- Newman C, Tsai J, Szarek M. et al. Comparative safety of atorvastatin 80 mg versus 10 mg derived from analysis of 49 completed trials in 14,236 patients. Am J Cardiol 2006;97(1):61-7.
- Law M, Rudnicka A. Statin safety: a systematic review. Am J Cardiol 2006; 97(8A):52C-60C.
- Lewis T, Cook J. Fluoroquinolones and tendinopathy: a guide for athletes and sports clinicians and a systematic review of the literature. J Athl Train 2014;49(3):422-7.
- Shu Y, Zhang Q, He X. et al. Fluoroquinolone-associated suspected tendonitis and tendon rupture: A pharmacovigilance analysis from 2016 to 2021 based on the FAERS database. Front Pharmacol 2022;13:990241.
- Kostine M, Finckh A, Bingham C. et al. EULAR points to consider for the diagnosis and management of rheumatic immune-related adverse events due to cancer immunotherapy with checkpoint inhibitors. Ann Rheum Dis 2021;80(1):36-48.
- Ghosh N, Tiongson M, Stewart C. et al. Checkpoint inhibitor-associated arthritis: a systematic review of case reports and case series. J Clin Rheumatol 2021;27(8):e317-22.
- Abdel-Wahab N, Suarez-Almazor ME. Frequency and distribution of various rheumatic disorders associated with checkpoint inhibitor therapy. Rheumatology (Oxford) 2019;58(Suppl 7):vii40-8.
