Гранулематоз с полиангиитом и микроскопический полиангиит – сходства и различия
Клинические проявления АНЦА-ассоциированных васкулитов (ААВ) сходные (лихорадка, боли в суставах, изменения в легких, мочевой синдром, кожная пурпура и т.д.), однако признаком гранулематоза с полиангиитом (ГПА), отличающим его от микроскопического полиангиита (МПА), является наличие гранулематозного воспаления верхних и нижних дыхательных путей, легких и/или орбиты. Важную роль в диагностике ААВ играют АНЦА, хотя они определяются не у всех больных и могут быть выявлены у пациентов с другими заболеваниями. ГПА чаще ассоциирован с АНЦА к протеиназе-3, а МПА – к миелопероксидазе, хотя эта закономерность прослеживается не всегда. В клиническом разборе на примере двух клинических наблюдений обсуждаются сходства и различия между ГПА и МПА и новые критерии, предложенные для классификации двух заболеваний.
С.В. Моисеев. Васкулиты, ассоциированные с антителами к цитоплазме нейтрофилов (ААВ), – это группа системных аутоиммунных заболеваний, характеризующихся некротизирующим воспалением стенок преимущественно мелких, реже – средних и крупных сосудов. Основной лабораторный признак ААВ – наличие циркулирующих антител к цитоплазме нейтрофилов (АНЦА), направленных против миелопероксидазы (МПО) или протеиназы-3 (ПР3), хотя они определяются не у всех пациентов [1]. В соответствии с современной номенклатурой, принятой в 1994 г. на Между народной конференции в Чапел-Хилл и пересмотренной в 2012 г., в группу ААВ объединяют гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА) [1,2], которые отличаются друг от друга по ряду клинических, морфологических и патофизиологических особенностей. Для всех ААВ характерно развитие васкулита с поражением мелких сосудов различной локализации, однако при ГПА также наблюдаются очаги гранулематозного воспаления в пораженных органах, а при ЭГПА – бронхиальная астма, эозинофильная инфильтрация тканей и эозинофилия в периферической крови. Существенное влияние на особенности течения заболевания оказывает тип АНЦА, частота выявления которых при различных ААВ отличается.
На примере двух клинических случаев мы хотели бы продемонстрировать типичную клиническую картину ГПА и МПА, сходства и различия проявлений заболеваний, их течения и подходов к терапии.
А.В. Скворцов. Пациентка Е., 42 года. В 2008 г. в возрасте 28 лет появились заложенность носа, затруднение носового дыхания и сухие корочки в носовых ходах, позднее – заложенность правого уха. По поводу предполагаемого евстахиита проведены антибактериальная терапия и физиотерапевтическое лечение в течение 2 недель с положительным эффектом. В августе 2011 г. повышение температуры тела до 38,5оС, усиление заложенности носа, выделение кровянистых корочек из носа. Диагностированы острый гайморит и искривление носовой перегородки. Наз начена антибактериальная терапия, которая была неэффективной. В октябре 2011 г. выявлена перфорация носовой перегородки. При гистологическом исследовании биоптата ткани слизистой оболочки носа определялись признаки гранулематозного воспаления, в связи с чем пациентка госпитализирована в ревматологическое отделение. При обследовании выявлены повышение содержания С-реактивного белка (СРБ) до 11,4 мг/л и титра ПР3-АНЦА до 3 норм, при рентгенографии – левосторонний гайморит. Диагностирован ГПА. Учитывая изолированное поражение верхних дыхательных путей при отсутствии других проявлений заболевания, проводилась терапия метотрексатом в дозе 7,5 мг/нед, которая привела к нормализации температуры тела и лабораторных маркеров активности и исчезновению симптомов со стороны ЛОР-органов. В декабре 2013 г. самочувствие вновь ухудшилось: усилилась заложенность носа и начали отделяться кровянистые корочки из носа. При компьютерной томографии органов грудной клетки обнаружены изменения по типу "матового стекла" в обоих легких, в связи с чем были отменен метотрексат и назначена индукционная терапия циклофосфамидом в дозе 1000 мг внутривенно каждые 3 недели и глюкокортикостероидами (метилпреднизолон 1000 мг внутривенно, а затем преднизолон 40 мг/сут внутрь).
В феврале 2014 г. впервые госпитализирована в клинику им. Е.М. Тареева. При компьютерной томографии инфильтративные изменения в легких не определялись, кровянистых выделений из носа нет. Титр ПР3-АНЦА – 20,1 Ед/мл (в норме до 5), СРБ – 3,6 мг/л. Подтвержден диагноз ГПА, ассоциированного с ПР3АНЦА, с поражением верхних дыхательных путей (полисинусит, язвенно-некротический ринит), легких (инфильтраты анамнестически) и органа слуха (евстахиит анамнестически). Индукционная терапия была завершена в апреле 2014 г., когда циклофосфамид (кумулятивная доза 6,2 г) был заменен на азатиоприн в дозе 50 мг/сут с постепенным повышением до 150 мг/сут. Продолжено постепенное снижение дозы преднизолона до 2,5 мг/сут к осени 2014 г.
В декабре 2014 г. усилилась заложенность носа, вновь появились кровянистые отделения из носа. Титр ПР3-АНЦА увеличился до 26 Ед/л. Учитывая отсутствие признаков поражений легких и других внутренних органов, было решено не возобновлять терапию циклофосфамидом, однако доза преднизолона была увеличена до 10 мг/сут, а азатиоприна – до 200 мг/сут. С 2015 г. – стойкая ремиссия заболевания, в связи с чем преднизолон был постепенно отменен в августе 2017 г., а азатиоприн – в апреле 2018 г.
В апреле 2019 г. отмечено нарастание активности ГПА, проявлявшееся заложенностью носа, выделением кровянистых корочек из носа, увеличением концентрации СРБ до 10,7 мг/л и титра ПР3-АНЦА, в связи с чем возобновлена терапия преднизолоном в дозе 10 мг/сут и азатиоприном в дозе 100 мг/сут. При ультразвуковом исследовании и мультиспиральной компьютерной томографии выявлено образование левой почки. В августе 2021 г. выполнены нефрэктомия и удаление пара аортальных лимфатических узлов. При гистологическом исследовании – папиллярный рак. После операции продолжала прием преднизолона в дозе 5 мг/сут.
В мае 2022 г. – очередное легкое обострение ГПА, проявлявшееся выраженной слабостью, сухостью в носу, повышением концентрации СРБ до 20,7 мг/л и титра ПР3-АНЦА. При компьютерной томографии легких и пазух носа отрицательной динамики не выявлено. Начата терапия микофенолата мофетилом в дозе 1000 мг/сут.
Е.Е. Филатова. Представленное клиническое наблюдение демонстрирует классическую картину ГПА, проявлявшегося язвенно-некротическим ринитом, поражением органа слуха и легких и повышением титра ПР3-АНЦА. Классификационные критерии этого заболевания были впервые предложены экспертами Американской коллегии ревматологов (АКР) в 1990 г. и включали в себя гематурию, изменения на рентгенограммах грудной клетки (узелки, полости или фиксированные инфильтраты), язвенно-некротический ринит и гранулематозное воспаление при гистологическом исследовании (при наличии по крайней мере двух критериев их чувствительность и специфичность составили 88,2% и 92,0%, соответственно) [3]. Таким образом, у обследованной нами пациентки имелись 3 из 4 перечисленных критериев ГПА. В первых классификационных критериях не учитывались АНЦА, так как их роль в патогенезе и диагностике ГПА была установлена позднее. Наличие ПР3- или МПО-АНЦА в качестве классификационного критерия ААВ было включено в алгоритм диагностики, разработанный группой экспертов в 2004-2006 г. по предложению Европейского агентства по лекарствам [4].
В этих рекомендациях были выделены также "суррогатные" маркеры гранулематозного воспаления, отличающего ГПА от МПА (рис. 1):- инфильтраты, узелки или полости в легких, сохраняющиеся ≥1 мес;
- стеноз бронхов;
- кровянистые выделения из носа и корочки ≥1 мес или язвы в носу;
- хронический синусит, средний отит или мастоидит в течение ≥3 мес
- псевдоопухоль орбиты;
- подскладочный стеноз трахеи;
- седловидная деформация носа/деструктивные изменения пазух.
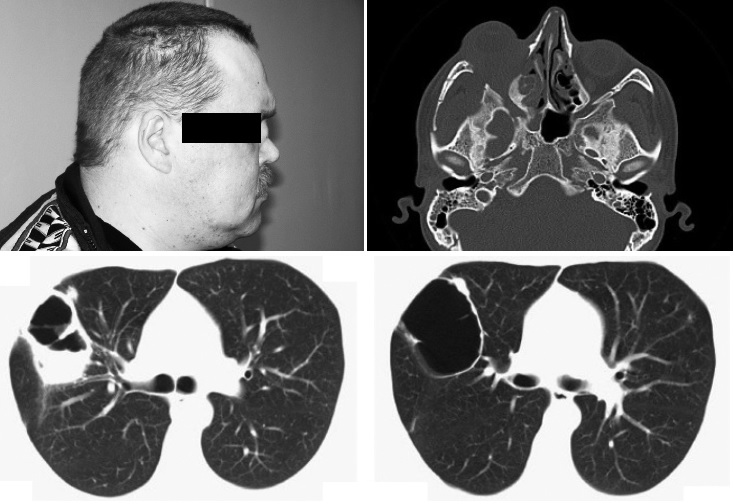
Целесообразность выделения указанных маркеров определялась тем, что гистологическое исследование биоптатов у пациентов с предполагаемым ААВ проводится не всегда и не считается обязательным для установления диагноза. Оно необходимо в тех случаях, когда диагноз системного васкулита вызывает сомнение, например, при изолированном поражении верхних дыхательных путей или псевдоопухоли орбиты, не сопровождающихся повышением титра АНЦА, а также при наличии поражения почек, так как результаты нефробиопсии имеют важное значение для оценки прогноза и выбора тактики лечения.
Учитывая изолированное поражение верхних дыхательных путей в дебюте заболевания, с целью индукции ремиссии пациентке был назначен метотрексат, который в рандомизированном клиническом исследовании у 100 пациентов с впервые выявленным ААВ, не сопровождавшимся поражением жизненно важных органов, по эффективности не уступал циклофосфамиду в дозе 2 мг/кг/сут внутрь [5]. Терапия метотрексатом не позволила избежать последующего прогрессирования ГПА, что, вероятно, стало следствием применения препарата в низкой дозе (7,5 мг/нед), которую в клиническом исследовании увеличивали до 20-25 мг/нед. Развитие поражения легких потребовало проведения стандартной индукционной терапии циклофосфамидом в дозе 15 мг/кг и глюкокортикостероидами с последующим переходом на поддерживающую терапию азатиоприном в сочетании с преднизолоном в низкой дозе [6]. В результате иммуносупрессивной терапии была достигнута стойкая ремиссия ГПА, которая продолжалась около 5 лет. Тем не менее, после отмены как преднизолона, так и азатиоприна у пациентки отмечались рецидивы ГПА, которые проявлялись нарастанием симптомов со стороны носа и титра ПР3-АНЦА. В настоящее время поддерживающую терапию рекомендуют продолжать в течение по крайней мере 2 лет после достижения стойкой ремиссии ААВ, хотя длительность ее может быть увеличена, особенно при наличии циркулирующих ПР3-АНЦА. В рандомизированном клиническом исследовании REMAIN увеличение длительности терапии азатиоприном и глюкокортикостероидами до 48 мес после достижения ремиссии ААВ сопровождалось снижением риска любых и тяжелых обострений по сравнению с таковым при проведении поддерживающей терапии в течение 24 мес (22% и 63%, p<0,0001, и 14% и 35%, p<0,007, соответственно) [7]. В последние годы в качестве альтернативы циклофосфамиду и/или азатиоприну широко применяют ритуксимаб, который можно назначать как для индукции ремиссии ААВ, так и поддерживающей терапии [8,9].
К.В. Кургинян. Пациентка А., 72 лет. Осенью 2017 г. в возрасте 67 лет появились общая слабость, утомляемость, повышение АД до 160/100 мм рт. ст., снижение массы тела на 5 кг. В мае 2018 г. выявлены нормохромная нормоцитарная анемия легкой степени тяжести (гемоглобин 94 г/л), повышение СОЭ до 54 мм/ч, острый нефритический синдром (протеинурия до 0,3 г/л, микрогематурия, повышение сывороточного уровня креатинина до 142 мкмоль/л). Исключена плазмаклеточная дискразия, антифосфолипидные антитела не определялись. В июле 2018 г. госпитализирована в клинику им. Е.М. Тареева. При обследовании картина быстропрогрессирующего гломерулонефрита (сывороточный уровень креатинина 253 мкмоль/л, мочевина 11,9 ммоль/л) в сочетании с прогрессирующей анемией (гемоглобин 84 г/л) и поражением легких ("матовое стекло" в S2 справа). Титр МПО-АНЦА – 8,29 ЕД/мл (норма 0-5). Выполнена биопсия почки. По данным светооптической микроскопии и иммуногистохимического исследования биоптата – экстракапиллярный малоиммунный гломерулонефрит с 63% преимущественно фиброзно-клеточных полулуний. Диагности ро ван МПА, ассоциированный с МПО-АНЦА, с поражением почек (быстропрогрессирующий гломерулонефрит, морфологически – экстракапиллярный гломерулонефрит III типа) и легких, хроническая болезнь почек С3б стадии (скорость клубочковой фильтрации [СКФ], рассчитанная по формуле по CKD-EPI 38 мл/мин/1,73 м2).
В течение 3 мес проводилась индукционная терапия циклофосфамидом (600 мг внутривенно с учетом возраста и функции почек; всего 4 инфузии) и глюкокортикостероидами (три инфузии метилпреднизолона в дозе 500 мг, а затем преднизолон в стартовой дозе 40 мг/сут внутрь), которая привела к исчезновению мочевого синдрома и изменений в легких, снижению сывороточного уровня креатинина до 109 мкмоль/л и нормализации АД. Учитывая достигнутую ремиссию ААВ, в сентябре 2018 г. циклофосфамид был заменен на азатиоприн в дозе 100 мг/сут, продолжено постепенное снижение дозы преднизолона до 5 мг/сут. Иммуносупрессивная терапия сопровождалась частыми инфекциями дыхательной и мочевыделительной систем. Пациентка переведена на поддерживающую терапию азатиоприном в дозе 100 мг/сут, продолжено снижение суточной дозы преднизолона до 5 мг/сут.
При повторной госпитализации в клинику в феврале 2020 г. отмечена ремиссия ААВ: анализ мочи в норме, изменений в легких при компьютерной томографии не выявлено, сывороточный уровень креатинина – 120 мкмоль/л (расчетная рСКФ – 39 мл/мин/1,73 м2). Преднизолон был отменен. Летом 2020 г. прекратила также прием азатиоприна в связи с отсутствием препарата в продаже.
В декабре 2020 г. перенесла новую коронавирусную инфекцию в легкой форме, подтвержденную методом ПЦР. В январе 2021 г. отметила нарастающую слабость. При обследовании выявлены острый нефритический синдром (сывороточный уровень креатинина – 183 мкмоль/л, микрогематурия, протеинурия 0,3 г/л) и снижение содержания гемоглобина до 95 г/л. В дальнейшем сывороточный уровень креатинина увеличился до 398 мкмоль/л, появилась гиперкалиемия (до 6,8 ммоль/л). Учитывая обострение МПА, проведена индукционная терапия циклофосфамидом (400 мг внутривенно; суммарная доза 5,7 г) и глюкокортикостероидами (три инфузии метилпреднизолона 500 мг, а затем преднизолон в стартовой дозе 40 мг/сут внутрь), которая привела к частичному восстановлению азотвыделительной функции почек (сывороточный уровень креатинина –139 мкмоль/л). С июня 2021 г. переведена на поддерживающую терапию азатиоприном 100 мг/сут в сочетании с преднизолоном в дозе 5 мг/сут. В последующем сохранялась ремиссия ААВ. В амбулаторных анализах креатинин сыворотки в пределах 147 мкмоль/л, анализ мочи без особенностей. Азото выде лительная функция почек стабильная – сывороточный уровень креатинина 142 мкмоль/л (СКФ – 32 мл/мин/1,73 м2). МПО-АНЦА не определялись, мочевой синдрома отсутствовал. Продолжает поддерживающую терапию азатиоприном 50 мг/сут и преднизолоном 5 мг/сут и нефропротективную терапию. С учетом снижения минеральной плотности костной ткани введена золендроновая кислота.
М.А. Литвинова. Ведущим в клинической картине заболевания было тяжелое поражение почек по типу быстропрогрессирующего гломерулонефрита (гистологически – экстракапиллярный гломерулонефрит III типа), сочетавшегося с интерстициальными изменениями в легких и повышением титра МПО-АНЦА. Эти клинические и лабораторные проявления типичны для МПА, в пользу диагноза которого свидетельствовало также отсутствие "суррогатных" маркеров гранулематозного воспаления. Как и в первом наблюдении, иммуносупрессивная терапия циклофосфамидом, доза которого была снижена с учетом пожилого возраста и нарушенной функции почек, и глюкокортикостероидами позволила достичь ремиссии ААВ, в том числе частичного восстановления азотвыделительной функции почек. Для индукции ремиссии был использован циклофос фамид, так как данных в пользу сопоставимой эффективности ритуксимаба у пациентов с быстропрогрессирующим гломерулонефритом недостаточно. Повторный курс индукционной терапии циклофосфамидом и глюкокортикостероидами при рецидиве заболевания, спровоцированном COVID-19, также оказался эффективным. Хотя у пациентки было отмечено дальнейшее ухудшение функции почек, тем не менее, она остается стабильной в течение года.
С.В. Моисеев. Представленные клинические наблюдения демонстрируют различия между ГПА и МПА, хотя на практике дифференцировать два варианта ААВ бывает нелегко. При этом схемы иммуносупрессивной терапии в обоих случаях были одинаковыми. Имеет ли смысл различать ГПА и МПА? более что она используется и в Международной классификации болезней 11-го пересмотра. Кроме того, в феврале 2022 года были опубликованы новые классификационные критерии ГПА, МПА и ЭГПА (табл. 1) [10-12], которые были разработаны на основании результатов крупного международного исследования DCVAS. В отличие от предыдущих инструментов, в новых классификационных критериях, предполагающих балльную оценку различных проявлений ААВ, большое значение придается серологическому профилю, т.е. типу циркулирующих АНЦА, однако критерии могут быть использованы и при серонегативных вариантах системного васкулита. Применение новых классификационных критериев ААВ в приведенных клинических случаях подтвердило установленные ранее диагнозы. У первой пациентки суммарный балл составил 10 (отделение кровянистых корочек из носа, ПР3АНЦА, гранулематозное воспаление при гистологическом исследовании биоптата), а у второй – 12 (МПО-АНЦА, интерстициальное поражение легких, малоиммунный гломерулонефрит по данным биопсии почки), что позволяет классифицировать ААВ как ГПА и МПА, соответственно. Следует учитывать, что новые классификационные критерии не предназначены для диагностики ААВ, должны в первую очередь использоваться для стандартизации отбора пациентов в научных исследованиях и, соответственно, не в полной мере удовлетворяют потребности практикующих врачей [13].
| ГПА | МПА | |||
|---|---|---|---|---|
| Примечание: Классификационные критерии могут быть использованы только в тех случаях, когда установлен диагноз системного васкулита с поражением с мелких или средних сосудов и исключены другие заболевания, имитирующие васкулит | ||||
| Клинические критерии | Поражение носа: кровянистые выделения, язвы, корки, заложенность или перфорация перегородки |
+3 | Поражение носа: кровянистые выделения, язвы, корки, заложенность или перфорация перегородки |
-3 |
| Поражение хрящей: воспаление уха или носа, охриплость голоса или стридор, эндобронхит или седловидная деформация носа |
+2 | |||
| Кондуктивная или нейросенсорная тугоухость | +1 | |||
| Лабораторные данные, рентгенография /КТ и биопсия |
ПР3-АНЦА или цАНЦА | +5 | МПО-АНЦА или пАНЦА | +6 |
| Узелки, инфильтраты или полости в легких | +2 | Фиброз или интерстициальное поражение легких при КТ | +3 | |
| Гранулемы, внесосудистое гранулематозное воспаление или гигантские клетки при биопсии |
+2 | Олигоиммунный гломерулонефрит при биопсии | +3 | |
| Воспаление или выпот в синусах или мастоидит | +1 | ПР3-АНЦА или цАНЦА | -1 | |
| Олигоиммунный гломерулонефрит при биопсии | +1 | Эозинофилия ≥1 × 109/л | -4 | |
| МПО-АНЦа или пАНЦА | -1 | |||
| Эозинофилия ≥1 × 109/л | -4 | |||
| Общий балл 10. Необходимо ≥5 баллов | Общий балл 12. Необходимо ≥5 баллов | |||
С.В. Моисеев. Какова роль АНЦА в диагностике ААВ? Насколько специфичны эти антитела для системного васкулита? Какой метод предпочтительно применять для определения АНЦА?
В большинстве европейских исследований у пациентов с ГПА чаще определялись ПР3-АНЦА, а у больных МПА – МПО-АНЦА. В генетических исследованиях у пациентов с ААВ выявлена ассоциация ПР3-АНЦА с носительством HLA-DR, SERPINA1 и PRTN3, кодирующих α1-антитрипсин и ПР3, соответственно, а МПО-АНЦА – с HLA-DQ [24,25]. Эти данные обычно используются в качестве одного из основных доводов в пользу внедрения новой классификации ААВ, основанной на типе циркулирующих АНЦА. В целом генетические исследования позволяют глубже изучить патогенез ААВ и возможные мишени терапевтического воздействия, в частности, они указывают на возможную роль сигнального пути, связанного с интерфероном-g, в развитии заболевания [26].
Несмотря на высокую информативность АНЦА в диагностике ААВ, они не являются патогномоничными для этого заболевания и могут определяться при других ревматических иммуновоспалительных заболеваниях, инфекциях, в том числе инфекционном эндокардите, туберкулезе и ВИЧ-инфекции, злокачественных опухолях, аутоиммунных заболеваниях печени, воспалительных заболеваниях кишечника, интерстициальной пневмонии, а также приеме некоторых лекарственных препаратов, например аллопуринола, антитиреоидных препаратов, ингибиторов фактора некроза опухоли-α и др. Данные обстоятельства были учтены в принятых в 2020 г. международных рекомендациях, в которых подробно рассматривается диагностическая и прогностическая ценность определения АНЦА не только при подозрении на ААВ, но и при ряде других заболеваний. Следует отметить, что в отношении подхода к выбору метода определения АНЦА авторы придерживаются изложенной ранее позиции: ИФА остается предпочтительным в клинической практике у пациентов с предполагаемым ААВ [27].
С.В. Моисеев. Одно из ведущих проявлений ААВ – поражение почек. Как часто гломерулонефрит встречается при ГПА и МПА? Каковы особенности его течения? Всем ли пациентам следует проводить биопсию почек, если лечение ААВ в любом случае предполагает применение иммуносупрессивных препаратов?
Н.М. Буланов. Одним из наиболее частых и прогностически значимых проявлений ААВ остается поражение почечного клубочка – АНЦА-ассоциированный гломерулонефрит, который нередко сочетается с поражением тубулоинтерстиция, а в ряде случаев – с тромботической микроангиопатией [28-30]. Частота поражения почек зависит от варианта ААВ и варьируется от 20% при ЭГПА до 70% при ГПА и почти 100% при МПА [31-33]. Наиболее тяжелый вариант поражения почек при ААВ, наблюдавшийся у второй пациентки, – быстропрогрессирующий гломерулонефрит, который чаще встречается у пациентов с МПА (или циркулирующими МПО-АНЦА) и характеризуется быстрым (в течение нескольких месяцев) нарастанием сывороточного уровня креатинина и снижением СКФ [34-37]. ААВ являются причиной около половины случаев быстропрогрессирующего гломерулонефрита, поэтому у всех больных с нефритическим синдромом, сопровождающимся быстрым ухудшением функции почек, необходимо исключать этот диагноз, в частности определять АНЦА. Признаками поражения почек при ААВ могут быть также микрогематурия и протеинурия, примерно у 10% больных развивается нефротический синдром [38,39].
Биопсия почки остается основным методом диагностики гломерулонефрита и рекомендуется всем больным ААВ с поражением почек при отсутствии противопоказаний [40-42]. При исследовании биоптатов с помощью светооптической микроскопии, как правило, выявляют картину экстракапиллярной пролиферации с формированием полулуний, некроз капиллярных петель, перигломерулярные и интерстициальные инфильтраты, некротизирующий артериит. При иммуногистохимическом исследовании фиксация иммуноглобулинов и комплемента в стенках сосудов обычно отсутствует или незначительная, поэтому данный тип экстракапиллярного гломерулонефрита получил название малоиммунного [42].
Биопсия почки позволяет не только подтвердить диагноз ААВ, но и оценить почечный прогноз. В соответствии с гистологической классификацией, разработанной при участии Европейской группы по изучению васкулитов (EUVAS), выделяют 4 морфологических класса АНЦА-ассоциированного гломерулонефрита: фокальный (≥50% нормальных клубочков), с полулуниями (≥50% клубочков с клеточными полулуниями), склеротический (≥50% глобально склерозированных клубочков) и смешанный (неоднородные изменения, которые нельзя отнести к вышеперечисленным классам) [42]. Данная классификация используется для стратификации риска прогрессирования хронической болезни почек (ХБП) у пациентов с ААВ и позволяет оценить почечную выживаемость, которая при склеротическом классе гломерулонефрита значительно ниже, чем при фокальном. Предложены и другие подходы к оценке риска развития хронической почечной недостаточности, в частности индекс ARRS [43].
Если пациенту с АНЦА-ассоциированным гломерулонефритом, особенно быстропрогрессирующим, не проводится адекватная иммуносупрессивная терапия, то возможна необратимая утрата почечной функции, требующая заместительной почечной терапии. Второе клиническое наблюдение демонстрирует эффективность своевременно начатой индукционной терапии циклофосфамидом и глюкокортикостероидами у пациентки с быстропрогрессирующим гломерулонефритом в рамках МПА. Хотя полного восстановления функции почек достичь не удалось, тем не менее, несмотря на длительный анамнез тяжелого поражения почек (около 5 лет) больная не нуждается в заместительной почечной терапии.
С.В. Моисеев. У первой пациентки основным проявлением ГПА было рецидивирующее поражение верхних дыхательных путей, проявлявшееся язвеннонекротическим ринитом и синуситом. Как указано выше, гранулематозное воспаление тканей носа, пазух, трахеи, легких и орбиты является основным отличительным признаком ГПА. Встречаются ли изменения верхних дыхательных путей при МПА?
М.А. Литвинова. Поражение верхних дыхательных путей встречается не только при ГПА, но и других ААВ. По данным исследования, проведенного в клинике им. Е.М. Тареева, самыми частыми клиническими вариантами поражения верхних дыхательных путей при ААВ были синусит и язвенно-некротический ринит, наблюдавшиеся в 73% и 70% случаев соответственно [44]. При ГПА поражение верхних дыхательных путей развивается у 90% больных и, наряду с поражением легких и почек, входит в "классическую триаду", характерную для этого заболевания. Первое клиническое наблюдение демонстрирует классическое течение ГПА, при котором в 80-95% случаев изменения со стороны ЛОРорганов возникают в начале заболевания и часто предшествуют его "трансформации" в системное заболевание [45]. Изолированное поражение ЛОР-органов и орбиты встречается только при ГПА и обычно не сопровождается повышением титра АНЦА, что затрудняет своевременную диагностику ААВ и задерживает назначение адекватного лечения, позволяющего предотвратить развитие деструктивных изменений [46]. В таких случаях диагностировать ААВ можно только с помощью гистологического исследования пораженных тканей, например, носа или орбиты.
В отличие от ГПА, при МПА чаще развивается поражение легких, в том числе тяжелое (диффузное альвеолярное кровотечение), в сочетании с почечной патологией. Тем не менее, при МПА также могут наблюдаться изменения со стороны верхних дыхательных путей, в том числе ринит, хронический риносинусит и рецидивирующие носовые кровотечения. По данным J. Wojciechowska и соавт., признаки поражения ЛОР-органов у больных МПА встречались реже, чем у пациентов с ГПА, но были выявлены более чем в половине случаев [45]. Следует еще раз подчеркнуть, что деструктивные и склеротические изменения носа и околоносовых пазух, отражающие наличие гранулематозного воспаления, нехарактерны для МПА и развиваются только при ГПА. Хотя поражение носа и носовых пазух не относится к числу опасных для жизни проявлений ГПА, тем не менее, оно может привести к седловидной деформации носа, а персистирующие симптомы (заложенность носа, выделения и т.п.), которые нередко сохраняются несмотря на достигнутую ремиссию заболевания, являются одной из основных причин снижения качества жизни пациентов.
С.В. Моисеев. Каковы современные подходы к лечению ААВ? Отличаются ли схемы иммуносупрессивной терапии у пациентов с ГПА и МПА?
Н.М. Буланов. Лечение ААВ можно условно разделить на два этапа: индукционная терапия, направленная на достижение ремиссии заболевания, и поддерживающая терапия, обеспечивающая профилактику его обострений. Традиционно в схему индукционной терапии входят глюкокортикостероиды, которые необходимо сочетать с различными иммуносупрессивными препаратами, прежде всего ритуксимабом или циклофосфамидом. Выбор препаратов и их доз зависит в основном не от варианта ААВ, а от наличия и тяжести поражения жизненно важных органов, прежде всего почек и легких. В прошлом глюкокортикостероиды пациентам с ААВ обычно назначали в высоких дозах (до 1 мг/кг в пересчете на преднизолон), однако в последние годы после публикации ряда исследований, продемонстрировавших рациональность снижения объема и продолжительности индукционной терапии, представления об оптимальных дозах и длительности лечения претерпели изменения [47], что нашло отражение в рекомендациях Американской коллегии ревматологов 2021 г. и согласуется с общей тенденцией к ограничению экспозиции глюкокортикостероидов при лечении аутоиммунных заболеваний [48]. В исследовании PEXIVAS было установлено, что применение глюкокортикостероидов в сниженных дозах по эффективности в профилактике терминальной хронической почечной недостаточности и смерти у пациентов с тяжелым ААВ не уступает лечению стандартными дозами, но сопровождается снижением риска инфекционных осложнений [49]. Тем не менее, выбирать стартовую дозу глюкокортикостероидов и темпы ее снижения следует индивидуально с учетом особенностей конкретного пациента и его ответа на лечение.
Рекомендации по индукционной терапии ААВ в значительной степени опираются на результаты двух рандомизированных контролируемых исследований (RAVE и RITUXVAS), подтвердивших сопоставимые эффективность и безопасность ритуксимаба и циклофосфамида (оба препарата применяли в комбинации с глюкокортикостероидами) у пациентов с ГПА и МПА с поражением жизненно важных органов [50,51]. Риту ксимаб по эффективности имел преимущество перед циклофосфамидом у пациентов с рецидивом ААВ, а также у больных, позитивных по ПР3-АНЦА, в то время как при наличии циркулирующих МПО-АНЦА результаты применения двух препаратов были сходными [52]. Результаты этих исследований свидетельствуют о том, что ритуксимаб следует рассматривать в качестве препарата первой линии у пациентов с рецидивом ААВ, особенно при наличии циркулирующих ПР3-АНЦА, а также при невозможности или нежелательности применения циклофосфамида, например, у молодых людей с учетом высокого риска развития бесплодия. Следует отметить, что в последние годы во всем мире, включая Россию, частота применения ритуксимаба для индукции ремиссии ААВ значительно увеличилась. Этому способствовало и снижение затрат на лечение благодаря появлению биоаналогов оригинального ритуксимаба.
П.И. Новиков. При отсутствии поражения жизненно важных органов для индукции ремиссии ААВ могут быть использованы и другие более безопасные иммуносупрессивные препараты, такие как метотрексат или микофенолата мофетил. Так, в первом наблюдении у пациентки с ГПА с изолированным поражением верхних дыхательных путей для индукционной терапии первоначально применялся метотрексат, хотя доза его была низкой (7,5 мг/нед), а глюкокортикостероиды одновременно назначены не были. Вероятно, с этим была связана последующая генерализация ААВ с развитием пора жения легких, что потребовало проведения более "агрессивной" иммуносупрессивной терапии циклофосфамидом и глюкокортикостероидами.
В прошлом лечение ААВ предполагало длительный прием циклофосфамида внутрь, однако сегодня этот препарат обычно вводят внутривенно (15 мг/кг; дозу снижают у пациентов пожилого возраста и с нарушенной функцией почек), а после достижения ремиссии заменяют на азатиоприн. Такая схема по эффективности не уступает лечению циклофосфамидом внутрь, но позволяет значительно уменьшить кумулятивную дозу циклофосфамида и, соответственно, риск серьезных нежелательных явлений. Для поддерживающей терапии может применяться и ритуксимаб, который в рандомизированных клинических исследованиях MAINRITSAN (500 мг каждые 6 мес) и RITAZAREM (1000 мг каждые 4 мес) имел преимущества перед азатиоприном [47]. В исследовании MAINRITSAN2 изучалась также возможность применения ритуксимаба "по требованию", т.е. при увеличении числа CD19+ клеток и/или удвоении титра АНЦА. Эту схему сравнивали с регулярным введением препарата в дозе 500 мг каждые 6 мес. Эффективность и безопасность двух схем поддерживающей терапии были сходными, однако в первом случае среднее число инфузий ритуксимаба было меньше [53]. Введение ритуксимаба "по требованию" возможно только в случае регулярного контроля указанных выше лабораторных показателей. В противном случае лучше придерживаться стандартной схемы поддерживающей терапии этим препаратом. Доза ритуксимаба может варьировать от 500 до 1000 мкг каждые 4-6 мес.
С.В. Моисеев. Хотя общепринятые критерии диагностики ААВ по-прежнему отсутствуют, заподозрить этот диагноз при наличии типичных системных проявлений обычно не так сложно. Важное диагностическое значение имеет наличие АНЦА, хотя они могут быть выявлены и при других заболеваниях, в том числе имитирующих картину системного васкулита, и нередко не определяются при локальных формах ГПА. В последнем случае подтвердить диагноз можно только путем гистологического исследования биоптата, например, слизистой оболочки носа или орбиты. Клини ческие проявления ААВ сходные (лихорадка, боли в суставах, изменения в легких, мочевой синдром, кожная пурпура и т.д.), однако отличительным признаком ГПА является наличие гранулематозного воспаления верхних и нижних дыхательных путей, легких и орбиты. Выбор иммуносупрессивных препаратов, их доз и длительность лечения зависит в большей степени не от нозологического диагноза, а от наличия и тяжести поражения жизненноважных органов, а также типа циркулирующих АНЦА. В последние годы отмечается тенденция к ограничению применения глюкокортикостероидов при ААВ (более низкие стартовые дозы, быстрое их снижение), а в качестве альтернативы циклофосфамиду широко применяют ритуксимаб. Учитывая высокий риск рецидива ААВ, особенно при наличии ПР3-АНЦА, все пациенты нуждаются в длительной поддерживающей иммуносупрессивной терапии. На фоне совершенствования схем лечения и улучшения прогноза пациентов с ААВ в настоящее время в структуре причин смертности на первый план выходят нежелательные последствия иммуносупрессивной терапии, в частности инфекции и сердечно-сосудистые осложнения, профилактика которых имеет не меньшее значение, чем лечение самого системного васкулита.
Используемые источники
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65(1):1-11.
- Новиков П.И., Семенкова Е.Н., Моисеев С.В. Современная номенклатура системных васкулитов. Клиническая фармакология и терапия 2013;22(1):70-4 [Novkov PO, Semenkova EN, Moiseev SV. Modern nomenclature of systemic vasculitis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2013;22(1):70-4 (In Russ.)].
- Leavitt RY, Fauci AS, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener's granulomatosis. Arthritis Rheum 1990;33(8):1101-7.
- Watts R, Lane S, Hanslik T, et al. Development and validation of a consensus methodology for the classification of the ANCA-associated vasculitides and polyarteritis nodosa for epidemiological studies. Ann Rheum Dis 2007;66(2):222–7.
- De Groot K, Rasmussen N, Bacon PA, et al. Randomized trial of cyclophosphamide versus methotrexate for induction of remission in early systemic antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum 2005;52(8): 2461-9.
- Jayne D, Rasmussen N, Andrassy K, et al; European Vasculitis Study Group. A randomized trial of maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies. N Engl J Med 2003;349(1):36-44.
- Karras A, Pagnoux C, Haubitz M, et al. Randomised controlled trial of prolonged treatment in the remission phase of ANCA-associated vasculitis. Ann Rheum Dis 2017;76(10):1662–8.
- Guillevin L, Pagnoux C, Karras A, et al. Rituximab versus azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med 2014;371(19):1771–80.
- Smith RM, Jones RB, Specks U, et al. Rituximab as therapy to induce remission after relapse in ANCA-associated vasculitis. Ann Rheum Dis 2020;79(9):1243–9.
- Robson J, Grayson P, Ponte C, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for granulomatosis with polyangiitis. Ann Rheum Dis 2022;81(3):315-20.
- Suppiah R, Robson J, Grayson P, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for microscopic polyangiitis. Ann Rheum Dis 2022;81(3):321-6.
- Grayson P, Ponte C, Suppiah R, et al. 2022 American College of Rheumato logy/European Alliance of Associations for Rheumatology Classification Criteria for Eosinophilic Granulomatosis with Polyangiitis. Ann Rheum Dis 2022;81:309-14.
- Буланов Н.М., Новиков П.И., Литвинова М.А., Моисеев С.В. Эволюция классификации системных васкулитов: от эпонимов к современным критериям. Терапевтический архив 2022;94(5):704–8 [Bulanov N, Novikov P, Litvinova M, Moiseev S. Evolution of classication of systemic vasculitides: from eponyms to modern criteria. Terapevticheskii Arkhiv 2022;94(5):704-8 (In Russ.)].
- Woude F, Rasmussen N, Lobatto S, et al. Autoantibodies against neutrophils and monocytes: tool for diagnosis and marker of disease activity in wegener’s granulomatosis. Lancet 1985;325:425–29.
- Falk R, Jennette JC. Anti-neutrophil cytoplasmic autoantibodies with specificity for myeloperoxidase in patients with systemic vasculitis and idiopathic necrotizing and crescentic glomerulonephritis. N Engl J Med 1988;318:1651–7.
- Kallenberg CG, Brouwer E, Weening JJ, Tervaert JW. Anti-neutrophil cytoplasmic antibodies: current diagnostic and pathophysiological potential. Kidney Int 1994;46:1–15.
- Niles JL, McCluskey RT, Ahmad MF, Arnaout MA. Wegener’s granulomatosis autoantigen is a novel neutrophil serine proteinase. Blood 1989;74:1888–93.
- Goldschmeding R, van der Schoot CE, ten Bokkel Huinink D, et al. Wegener's granulomatosis autoantibodies identify a novel diisopropylfluorophosphate-binding protein in the lysosomes of normal human neutrophils. J Clin Invest 1989;84(5): 1577-87.
- Jenne DE, Tschopp J, LЯdemann J, et al. Wegener's autoantigen decoded. Nature 1990;346(6284):520.
- Savige JA, Paspaliaris B, Silvestrini R, et al. A review of immunofluorescent patterns associated with antineutrophil cytoplasmic antibodies (ANCA) and their differentiation from other antibodies. J Clin Pathol 1998;51:568–75.
- Тищенко В.А., Бекетова Т.В., Семенкова Е.Н. и др. Антинейтрофильные цитоплазматические антитела при гранулематозе Вегенера: анализ с помощью иммуноферментного и иммунофлюоресцентного методов. Терапевтический архив 1995;5:48.
- Guchelaar N, Waling M, Adhin A, et al. The value of anti-neutrophil cytoplasmic antibodies (ANCA) testing for the diagnosis of ANCA-associated vasculitis, a systematic review and meta-analysis. Autoimmun Rev 2021;20(1):102716.
- Bossuyt X, Cohen Tervaert J-W, Arimura Y, et al. Revised 2017 international consensus on testing of ANCAs in granulomatosis with polyangiitis and microscopic polyangiitis. Nat Rev Rheumatol 2017;13(11):683-92.
- Lyons PA, Rayner TF, Trivedi S, et al. Genetically distinct subsets within ANCAassociated vasculitis. N Engl J Med 2012;367:214-23.
- Watts R, Scott DG. ANCA vasculitis: to lump or split? Why we should study MPA and GPA separately. Rheumatology 2012;51:2115–7.
- Lee KS, Kronbichler A, Pereira Vasconcelos DF, et al. Genetic variants in antineutrophil cytoplasmic antibody-associated vasculitis: A Bayesian approach and systematic review. J Clin Med 2019;8(2):266
- Moiseev S, Cohen Tervaert JW, Arimura Y, et al. 2020 international consensus on ANCA testing beyond systemic vasculitis. Autoimmun Rev 2020;19(9):102618.
- de Lind van Wijngaarden RA, Hauer HA, Wolterbeek R, et al. Clinical and histologic determinants of renal outcome in ANCA-associated vasculitis: A prospective analysis of 100 patients with severe renal involvement. J Am Soc Nephrol 2006;17(8):2264-74.
- Буланов Н.М., Моисеев С.В., Новиков П.И. и др. Поражение почек при различных вариантах АНЦА-ассоциированного васкулита. Клин фармакол тер 2016;5:23-9 [Bulanov N, Moiseev S, Novikov P, et al. Renal involvement in ANCA-associated vasculitis. Klinicheskaya farmakologiya i terapiya = Clin Pharma col Ther 2016;5:23-9 (In Russ.)].
- Томилина Н.А., Бирюкова Л.С., Фролова Н.Д. и др. Клинико-морфологическая характеристика и прогноз разных гистоморфологических вариантовбыстропрогрессирующего гломерулонефрита, ассоциированного с АНЦАваскулитом. Нефрология и диализ 2017;19(4):466-77 [Tomilina N, Biryukova L, Frolova N, et al. Clinical and morphological characteristics and prognosis of different histomorphological variants of rapidly progressing glomerulonephritis associated with ANCA-vasculitis. Nephrology and dialysis 2017;19(4):466-77 (In Russ.)].
- Guillevin L, Cohen P, Gayraud M, et al. Churg-Strauss syndrome. Clinical study and long-term follow-up of 96 patients. Medicine 1999;78:26–37.
- Lee RW, D’Cruz DP. Pulmonary renal vasculitis syndromes. Autoimmun Rev 2010;10(9):657–60.
- Villiger PM, Guillevin L. Microscopic polyangiitis: Clinical presentation. Autoimmun Rev 2010;9:812–9.
- Mukhtyar C, Flossmann O, Hellmich B, et al. Outcomes from studies of antineutrophil cytoplasm antibody associated vasculitis: a systematic review by the European League Against Rheumatism systemic vasculitis task force. Ann Rheum Dis 2008;67:1004–10.
- Новиков П.И., Моисеев С.В., Кузнецова Е.И. и др. Изменение клинического течения и прогноза гранулематоза с полиангиитом (Вегенера): результаты 40-летнего наблюдения. Клин фармакол тер 2014;23(1):32–7 [Novikov P, Moiseev S, Kuznetsova E, et al. Changes in the clinical course and prognosis in granulomatosis with polyangiitis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2014;23(1):32–7 (In Russ.)].
- Couser WG. Rapidly progressive glomerulonephritis: classification, pathogenetic mechanisms, and therapy. Am J Kidney Dis 1988;11:449–64.
- Little MA, Pusey CD. Rapidly progressive glomerulonephritis: current and evolving treatment strategies. J Nephrol 2004;Suppl 8:S10-9.
- Savage CO, Winearls CG, Evans DJ, et al. Microscopic polyarteritis: presentation, pathology and prognosis. Q J Med1985;220:467–83.
- Savage CO, Harper L, Adu D. Primary systemic vasculitis. Lancet 1997;349:553– 8.
- Hauer HA, Bajema IM, van Houwelingen HC, et al. Renal histology in ANCAassociated vasculitis: differences between diagnostic and serologic subgroups. Kidney Int 2002;61:80–9.
- Falk RJ, Moore DT, Hogan SL, Jennette JC. A renal biopsy in essential for the management of ANCA-positive patients with glomerulonephritis. Sarcoidosis Vasc Diffuse Lung Dis 1996;13(3):230-1.
- Berden AE, Ferrario F, Hagen EC, et al. Histopathologic classification of ANCAassociated glomerulonephritis. J Am Soc Nephrol 2010;21(10):1628-36.
- Brix SR, Noriega M, Tennstedt P, et al. Development and validation of a renal risk score in ANCA-associated glomerulonephritis. Kidney Int 2018;94:1177-88.
- Смирнова И.Г., Буланов Н.М., Новиков П.И. и др. Варианты поражения верхних дыхательных путей при различных нозологических формах и серотипах АНЦА-ассоциированных васкулитов. Научно-практическая ревматология 2021;59(5):555–62.
- Wojciechowska J, Krсicki T. Clinical characteristics of patients with granulomatosis with polyangiitis and microscopic polyangiitis in ENT practice: A comparative analysis. Acta Otorhinolaryngol Ital 2018;38(6):517-27.
- Srouji IA, Andrews P, Edwards C, Lund VJ. General and rhinosinusitis-related quality of life in patients with Wegener’s granulomatosis. Laryngoscop 2006;116(9):1621-5.
- Буланов Н.М., Козловская Н.Л., Тао Е.А. и др. Современные подходы к лечению АНЦА-ассоциированных васкулитов с поражением почек с позиций медицины, основанной на доказательствах. Клин фармакол тер 2020;29(4):72-84 [Bulanov N, Kozlovskaya N, Tao E, et al. Evidencebased treatment of ANCA-associated vasculitis with kidney involvement. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(4):72-84 (In Russ.)].
- Chung SA, Langford CA, Maz M, et al. 2021 American College of Rheumatology/Vasculitis Foundation guideline for the management of antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheumatol 2021;73:1366-83.
- Walsh M, Merkel PA, Peh CA, et al. Plasma exchange and glucocorticoids in severe ANCA-associated vasculitis. N Engl J Med. 2020;382:622-31.
- Stone JH, Merkel PA, Spiera R, Seo P, et al.; RAVE-ITN Research Group. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med 2010;363(3):221-32.
- Jones RB, Tervaert JW, Hauser T, et al.; European Vasculitis Study Group. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Engl J Med. 2010;363(3):211-20.
- Unizony S, Villarreal M, Miloslavsky E, et al. Clinical outcomes of treatment of anti-neutrophil cytoplasmic antibody (ANCA)-associated vasculitis based on ANCA type. Ann Rheum Dis 2017;75(6):1166-9.
- Charles P, Terrier B, Perrodeau F, et al. Comparison of individually tailored versus fixed-schedule rituximab regimen to maintain ANCA-associated vasculitis remission: Results of a multicentre, randomised controlled, phase III trial (MAINRITSAN2). Ann Rheum Dis 2018;77(8):1144-50.
