Фармакоэпидемиологическое исследование безопасности антипсихотических средств на основе анализа спонтанных сообщений по данным подсистемы «Фармаконадзор»
Анализ спонтанных сообщений (CC) о нежелательных лекарственных реакциях (НЛР), зарегистрированных в подсистеме “Фармаконадзор 2.0” АИС Росздравнадзора при назначении антипсихотических средств.
Был проведен ретроспективный фармакоэпидемиологический анализ спонтанных сообщений о НЛР, наблюдавшихся при применении зарегистрированных в России типичных и атипичных антипсихотиков и зарегистрированных в электронной базе с 01.04.2019 г. (с даты начала функционирования обновленной базы данных) по 30.11.2022 г.
Всего за исследуемый период в электронной базе данных было зарегистрировано 1683 СС о НЛР, возникших при применении зарегистрированных в России антипсихотических средств: 872 – для типичных и 811 – для атипичных. Для типичных антипсихотиков чаще всего направлялись СС о НЛР, относящихся к категории “Неврологические НЛР” (388 СС, 43,31%) и “Соматические НЛР” (287 СС, 32,04%). Преобладали НЛР типа А, т.е. предсказуемые дозозависимые нежелательные реакции, связанные с фармакологической активностью лекарственных средств.
Среди НЛР, зарегистрированных для типичных антипсихотиков, преобладали экстрапирамидные расстройства, в то время как для атипичных антипсихотиков наиболее характерными были эндокринные и метаболические нарушения.
Нежелательные лекарственные реакции (НЛР) остаются одной из основных проблем здравоохранения во всем мире [1]. Они влияют на результаты лечения, увеличивают частоту госпитализаций и стоимость терапии, повышают показатели заболеваемости и смертности, влияют на качество жизни и удовлетворенность пациентов оказываемой им медицинской помощью [2]. По оценкам экспертов, НЛР занимают четвертое-шестое место среди наиболее распространенных причин смерти, находясь в одном ряду с сердечно-сосудистыми заболеваниями, злокачественными новообразованиями и инсультом [3]. Бремя НЛР еще более усугубилось в связи с пандемией COVID-19 [4].
Антипсихотики (нейролептики) – класс психотропных средств, которые применяют для лечения психотической симптоматики и/или психомоторного возбуждения [5], в том числе при шизофрении, биполярном аффективном расстройстве, депрессивном расстройстве и др. [6,7]. Длительное лечение антипсихотическими препаратами сопряжено с развитием таких НЛР, как увеличение массы тела, сексуальная дисфункция, экстрапирамидные расстройства, ортостатическая гипотензия, гиперпролактинемия [8]. НЛР, вызванные антипсихотиками, негативно влияют на соблюдение пациентом режима приема лекарств, ухудшают его состояние и даже повышают риск развития некоторых заболеваний [9]. По данным некоторых пострегистрационных исследований, 50-80% НЛР и связанных с ними госпитализаций потенциально предотвратимы [10], а их мониторинг представляет собой один из наиболее важных процессов в рамках системы фармаконадзора [11].
В 1968 г. при поддержке Всемирной организации здравоохранения (ВОЗ) была создана международная программа для обеспечения сбора данных из максимально возможного числа источников о возможных негативных последствиях применения ЛС [12]. VigiBase – самая крупная международная база данных такого рода, содержащая более 22 млн спонтанных сообщений, отправленных в ВОЗ с 1968 г. В настоящее время полноценными участниками программы международного мониторинга безопасности ЛС являются 136 стран и 29 ассоциированных стран-участниц, на территории которых проживает более 90% населения мира [13]. В России в соответствии с постановлением Правительства Российской Федерации от 30.06.2004 № 323 "Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения" полномочия по федеральному государственному надзору в сфере обращения ЛС возложены на Росздравнадзор.
В настоящее время наиболее распространенным методом осуществления фармаконадзора в мире является метод спонтанных сообщений, который предполагает добровольную передачу специалистом системы здравоохранения или потребителем данных о НЛР, возникшей на фоне применения ЛС, в адрес уполномоченного органа в сфере фармаконадзора [14]. Данный метод имеет очевидные преимущества, к которым относятся простота его применения и широкий охват, включающий все популяции пациентов. Однако как специалисты, так и потребители далеко не всегда сообщают о НЛР, поэтому на практике реальное их количество значительно превышает количество зарегистрированных извещений. Например, в Велико бри тании, Швеции и Канаде, которые относятся к странам с высоким уровнем сообщаемости, выявляется не более 10% от общего числа серьезных НЛР [15]. Кроме того, метод спонтанных сообщений не позволяет установить истинную частоту возникновения НЛР, поскольку для этого необходимы данные об объеме потребления ЛС. Наконец, известно, что наибольшее количество спонтанных сообщений о НЛР регистрируется в течение первых лет применения препарата в клинической практике, в то время как со временем наиболее распространенные нежелательные реакции становятся хорошо известными практикующим врачам, которые реже о них сообщают [16].
Целью исследования было провести фармакоэпидемиологический анализ спонтанных сообщений о НЛР, зарегистрированных в подсистеме "Фармаконадзор 2.0" АИС Росздравнадзора при назначении антипсихотических ЛС.
Материал и методы
В ретроспективном фармакоэпидемиологическом обсер вационном исследовании анализировали спонтанные сообщения о НЛР, возникших при применении зарегистрированных в России типичных антипсихотиков (алимемазина тартрат, галоперидол, дроперидол, зуклопентиксол, левомепромазин, перициазин, перфеназин, тиопроперазин, тиоридазин, трифлуоперазин, флупентиксол, флуфеназин, хлорпромазин, хлорпротиксен – всего 14 МНН) и атипичных антипсихотиков (азенапин, амисульприд, арипипразол, брекспипразол, зипрасидон, кветиапин, клозапин, луразидон, оланзапин, палиперидон, рисперидон, сертиндол, сульпирид, тиаприд – всего 14 МНН) и зарегистрированных в электронной базе данных подсистемы "Фарма конадзор 2.0" АИС Росздравнадзора за период с 01.04.2019 г. (с даты начала функционирования обновленной базы данных) по 30.11.2022 г. Данные для анализа были предоставлены Центром фармаконадзора ФГБУ "ИМЦЭУАОСМП" Росздравнадзора в электронном виде с соблюдением действующего законодательства о защите персональных данных и врачебной тайне.
Критерием включения в исследование было наличие среди ЛС, подозреваемых в развитии НЛР, одного или нескольких антипсихотических ЛС. Из исследования исключали дубликаты и невалидные спонтанные сообщения в соответствии с Правилами надлежащей практики фармаконадзора Евразийского экономического союза. Причинно-следственную связь оценивали посредством классификации ВОЗ (WHO-UMC). В исследование включали спонтанные сообщения, для которых причинноследственная связь хотя бы одной из указанных сторон была оценена как "возможная", "вероятная" или "определенная".
Результаты
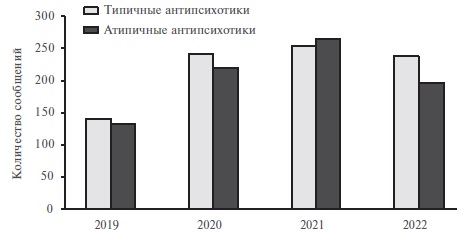
Всего за период с 01.04.2019 г. по 30.11.2022 г. в электронной базе данных подсистемы "Фармаконадзор 2.0" АИС Росздравнадзора было зарегистрировано 1683 спонтанных сообщений о НЛР, возникших при применении зарегистрированных в России антипсихотических ЛС: 872 – для типичных (алимемазина тартрат, галоперидол, дроперидол, зуклопентиксол, левомепромазин, перициазин, перфеназин, тиопроперазин, тиоридазин, трифлуоперазин, флупентиксол, флуфеназин, хлорпромазин, хлорпротиксен — всего 14 МНН) и 811 – для атипичных антипсихотиков (азенапин, амисульприд, арипипразол, брекспипразол, зипрасидон, кветиапин, клозапин, луразидон, оланзапин, палиперидон, рисперидон, сертиндол, сульпирид, тиаприд — всего 14 МНН). В качестве показаний к назначению указанных ЛС чаще всего указывались шизофрения, психотические расстройства и биполярное аффективное расстройство. Данные о динамике количества спонтанных сообщений о НЛР представлены в табл. 1.
| 2019 | 2020 | 2021 | 2022 | Всего | |
|---|---|---|---|---|---|
| Типичные антипсихотики | |||||
| Алимемазина тартрат | 0 | 0 | 2 | 0 | 2 |
| Галоперидол | 50 | 64 | 70 | 81 | 256 |
| Дроперидол | 1 | 4 | 2 | 3 | 10 |
| Зуклопентиксол | 11 | 15 | 26 | 8 | 60 |
| Левомепромазин | 4 | 16 | 18 | 14 | 52 |
| Перициазин | 14 | 25 | 28 | 39 | 106 |
| Перфеназин | 2 | 7 | 6 | 4 | 19 |
| Тиопроперазин | 0 | 0 | 0 | 0 | 0 |
| Тиоридазин | 15 | 25 | 18 | 22 | 80 |
| Трифлуоперазин | 3 | 11 | 14 | 4 | 32 |
| Флупентиксол | 3 | 9 | 1 | 0 | 13 |
| Флуфеназин | 2 | 1 | 1 | 1 | 6 |
| Хлорпромазин | 14 | 24 | 40 | 37 | 115 |
| Хлорпротиксен | 20 | 40 | 28 | 24 | 112 |
| Итого | 139 | 242 | 254 | 237 | 872 |
| Атипичные антипсихотики | |||||
| Азенапин | 0 | 0 | 0 | 0 | 0 |
| Амисульприд | 2 | 6 | 2 | 1 | 11 |
| Арипипразол | 5 | 3 | 4 | 5 | 17 |
| Брекспипразол | 0 | 0 | 0 | 0 | 0 |
| Зипрасидон | 9 | 0 | 0 | 1 | 10 |
| Кветиапин | 24 | 38 | 53 | 45 | 160 |
| Клозапин | 27 | 30 | 31 | 37 | 125 |
| Луразидон | 0 | 5 | 9 | 2 | 16 |
| Оланзапин | 10 | 18 | 28 | 26 | 82 |
| Палиперидон | 9 | 38 | 13 | 13 | 73 |
| Рисперидон | 34 | 62 | 104 | 56 | 256 |
| Сертиндол | 4 | 2 | 4 | 0 | 10 |
| Сульпирид | 8 | 17 | 12 | 9 | 46 |
| Тиаприд | 0 | 1 | 4 | 0 | 5 |
| Итого | 132 | 220 | 264 | 195 | 811 |
Лидерами по количеству спонтанных сообщений о НЛР были типичные антипсихотические ЛС галоперидол (30,39% от общего числа спонтанных сообщений для типичных антипсихотиков и 15,75% от общего числа спонтанных сообщений для всех антипсихотиков), хлорпромазин (13,19% и 6,84%), хлорпротиксен (12,85% и 6,66%), перициазин (12,16% и 6,30%) и тиоридазин (9,18% и 4,76%), а также атипичные антипсихотические ЛС рисперидон (31,57% от общего числа спонтанных сообщений для атипичных антипсихотиков и 15,21% от общего числа спонтанных сообщений для всех антипсихотиков), кветиапин (19,73% и 9,51%), клозапин (15,42% и 7,43%), оланзапин (10,11% и 4,88%) и палиперидон (9,01% и 4,34%). Возможно, эти показатели отражают объем потребления ЛС (чем чаще применяется ЛС, тем чаще сообщается о возникновении НЛР на фоне его применения). В базе данных не было выявлено сообщений о НЛР при применении типичного антипсихотика тиопроперазина, а также атипичных нейролептиков азенапина и брекспипразола. Это может быть связано с тем, что азенапин был изъят из обращения на территории РФ в 2017 г., а брекспипразол зарегистрирован в РФ в 2022 году, но фактически стал доступен лишь в ноябре-декабре 2022 г. Три указанных ЛС (тиопроперазин, азенапин и брекспипразол) были исключены из дальнейшего анализа.
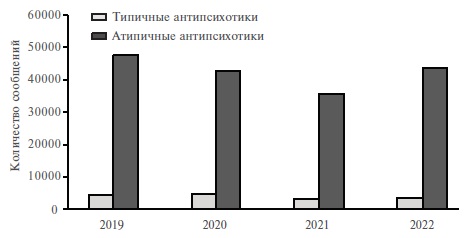
Динамика суммарного количества спонтанных сообщений о НЛР при применении типичных и атипичных антипсихотиков в РФ в 2019–2022 гг. представлена на рис. 1. Как видно на рисунке, количество зарегистрированных Росздравнадзором спонтанных сообщений о НЛР во все исследуемые годы было сопоставимым для типичных и атипичных антипсихотиков. Пики количества спонтанных сообщений о НЛР при применении большинства атипичных антипсихотиков в разные годы в целом совпадали с периодами регистрации препаратов-дженериков в РФ и началом их применения в обычной клинической практике.
Для сравнения нами были проанализированы данные о количестве НЛР, зарегистрированных в международной базе данных ВОЗ VigiBase с 2019 по 2022 гг. (табл. 2). Количество сообщений, полученных ВОЗ, было значительно выше, что обусловлено большим количеством стран, участвующих в мониторинге, и более жесткой политикой фармаконадзора в данных странах. В литературе неоднократно обсуждался вопрос о том, что при проведении клинических исследований количество репортируемых нежелательных явлений на территории РФ примерно в 10 раз ниже, чем в других странах [17]. В международной базе данных ВОЗ VigiBase наибольшее количество спонтанных сообщений о НЛР было зарегистрировано для типичных антипсихотических ЛС галоперидола (50,83% от общего числа спонтнных сообщений для типичных антипсихотиков и 4,51% от общего числа спонтанных сообщений для всех антипсихотиков), хлорпромазина (13,31% и 1,18%), зуклопентиксола (6,44% и 0,57%), алимемазина тартрата (5,77% и 0,52%) и левомепромазина (5,15% и 0,46%), а также атипичных антипсихотических ЛС клозапина (35,97% от общего числа спонтанных сообщений для атипичных антипсихотиков и 32,78% от общего числа спонтанных сообщений для всех антипсихотиков), рисперидона (13,55% и 12,35%), арипипразола (11,40% и 10,39%), кветиапина (10,41% и 9,49%) и оланзапина (8,98% и 8,18%). В базе данных ВОЗ VigiBase за указанный период не было выявлено сообщений о НЛР при применении типичного антипсихотика тиопроперазина.
| 2019 | 2020 | 2021 | 2022 | Всего | |
|---|---|---|---|---|---|
| Типичные антипсихотики | |||||
| Алимемазина тартрат | 313 | 336 | 134 | 169 | 952 |
| Галоперидол | 2164 | 2562 | 1607 | 2052 | 8385 |
| Дроперидол | 110 | 117 | 76 | 91 | 394 |
| Зуклопентиксол | 317 | 282 | 231 | 231 | 1061 |
| Левомепромазин | 260 | 219 | 168 | 202 | 849 |
| Перициазин | 21 | 23 | 17 | 21 | 82 |
| Перфеназин | 184 | 306 | 148 | 163 | 801 |
| Тиопроперазин | 0 | 0 | 0 | 0 | 0 |
| Тиоридазин | 29 | 10 | 17 | 56 | 112 |
| Трифлуоперазин | 82 | 72 | 40 | 140 | 334 |
| Флупентиксол | 165 | 161 | 174 | 112 | 612 |
| Флуфеназин | 176 | 99 | 124 | 162 | 561 |
| Хлорпромазин | 569 | 733 | 409 | 484 | 2195 |
| Хлорпротиксен | 51 | 54 | 24 | 31 | 160 |
| Итого | 4441 | 4974 | 3169 | 3914 | 16498 |
| Атипичные антипсихотики | |||||
| Азенапин | 343 | 84 | 72 | 95 | 594 |
| Амисульприд | 548 | 945 | 594 | 567 | 2654 |
| Арипипразол | 5302 | 4828 | 3066 | 6117 | 19313 |
| Брекспипразол | 1845 | 1090 | 959 | 1051 | 4945 |
| Зипрасидон | 540 | 558 | 429 | 404 | 1931 |
| Кветиапин | 4944 | 5014 | 3924 | 3755 | 17637 |
| Клозапин | 15072 | 14254 | 13494 | 18147 | 60967 |
| Луразидон | 3092 | 1404 | 2393 | 1476 | 8365 |
| Оланзапин | 3805 | 4341 | 3394 | 3677 | 15217 |
| Палиперидон | 4354 | 2949 | 2936 | 3409 | 13648 |
| Рисперидон | 7237 | 6954 | 4119 | 4648 | 22958 |
| Сертиндол | 8 | 5 | 5 | 7 | 25 |
| Сульпирид | 296 | 321 | 165 | 178 | 960 |
| Тиаприд | 106 | 97 | 49 | 44 | 296 |
| Итого | 47492 | 42844 | 35599 | 43575 | 16951 |
Динамика суммарного количества спонтанных сообщений о возникновении НЛР при применении типичных и атипичных антипсихотиков в странах ВОЗ за период 2019–2022 гг. представлена на рис. 2. Приведенные данные наглядно демонстрируют значительную разницу между количеством спонтанных сообщений о НЛР, зарегистрированных для типичных и атипичных антипсихотиков. С одной стороны, это может быть обусловлено тем, что наиболее распространенные нежелательные эффекты типичных нейролептиков хорошо известны практикующим врачам, вследствие чего частота сообщений о них значительно снижается по сравнению с атипичными антипсихотическими ЛС. С другой стороны, после истечения сроков действия патентной защиты на "ЛС-блокбастеры" из группы атипичных антипсихотиков увеличилось количество зарегистрированных дженериков, выход которых на фармацевтические рынки мог способствовать увеличению частоты сообщений о возникновении НЛР на фоне их применения.
В большинстве случаев отправителями спонтанных сообщений о НЛР в РФ были медицинские работники (71,42%), в то время как остальные 28,58% сообщений были получены от других субъектов обращения ЛС: фармацевтических компаний, Центрального аппарата и Территориальных подразделений Росздравнадзора, дистрибьюторов и сотрудничающих центров ВОЗ по международному мониторингу ЛС (табл. 3).
| Антипсихотики, МНН | Фарм. компания |
Мед. работник |
Рег. центр фармаконадзора |
Уполномоченный орган |
Другое* |
|---|---|---|---|---|---|
| Примечание: *дистрибьютор, сотрудничающие центры ВОЗ по международному мониторингу ЛС | |||||
| Типичные | |||||
| Алимемазина тартрат | 2 | 0 | 0 | 0 | 0 |
| Галоперидол | 9 | 197 | 24 | 34 | 1 |
| Дроперидол | 0 | 6 | 0 | 1 | 3 |
| Зуклопентиксол | 0 | 40 | 12 | 8 | 0 |
| Левомепромазин | 1 | 42 | 4 | 5 | 0 |
| Перициазин | 0 | 91 | 1 | 14 | 0 |
| Перфеназин | 1 | 15 | 3 | 0 | 0 |
| Тиоридазин | 1 | 63 | 2 | 14 | 0 |
| Трифлуоперазин | 0 | 27 | 4 | 1 | 0 |
| Флупентиксол | 1 | 8 | 2 | 2 | 0 |
| Флуфеназин | 0 | 4 | 0 | 2 | 0 |
| Хлорпромазин | 4 | 79 | 11 | 21 | 0 |
| Хлорпротиксен | 5 | 81 | 2 | 23 | 1 |
| Итого | 24 | 653 | 65 | 125 | 5 |
| Атипичные | |||||
| Амисульприд | 1 | 9 | 0 | 1 | 0 |
| Арипипразол | 3 | 13 | 1 | 0 | 0 |
| Зипрасидон | 6 | 3 | 0 | 1 | 0 |
| Кветиапин | 12 | 91 | 30 | 26 | 1 |
| Клозапин | 9 | 90 | 6 | 20 | 0 |
| Луразидон | 4 | 6 | 5 | 0 | 1 |
| Оланзапин | 8 | 54 | 14 | 6 | 0 |
| Палиперидон | 39 | 28 | 4 | 2 | 0 |
| Рисперидон | 18 | 214 | 17 | 7 | 0 |
| Сертиндол | 0 | 7 | 3 | 0 | 0 |
| Сульпирид | 3 | 34 | 4 | 4 | 1 |
| Тиаприд | 4 | 0 | 0 | 1 | 0 |
| Итого | 107 | 549 | 84 | 68 | 3 |
С целью анализа структуры НЛР, возникающих при применении антипсихотических ЛС, мы использовали классификацию Д.И. Малина, в соответствии с которой выделяют неврологические НЛР (экстрапирамидные расстройства), психические НЛР, соматические НЛР и злокачественный нейролептический синдром (табл. 4) [18]. Если одно спонтанное сообщение содержало информацию о нескольких НЛР, такие события рассматривали по отдельности за исключением случаев, когда они могли быть объединены согласно правилам кодирования. В связи с этим общее количество НЛР в табл. 4 не соответствует общему количеству зарегистрированных спонтанных сообщений.
| Антипсихотики, МНН | Неврологические НЛР |
Психические НЛР |
Соматические НЛР |
ЗНС | Итого |
|---|---|---|---|---|---|
| Примечание: ЗНС - злокачественный нейролептический синдром | |||||
| Типичные | |||||
| Алимемазина тартрат | 0 | 0 | 2 | 0 | 2 |
| Галоперидол | 148 | 45 | 73 | 10 | 276 |
| Дроперидол | 1 | 0 | 9 | 0 | 10 |
| Зуклопентиксол | 35 | 10 | 14 | 3 | 62 |
| Левомепромазин | 21 | 10 | 20 | 1 | 52 |
| Перициазин | 62 | 18 | 28 | 2 | 110 |
| Перфеназин | 8 | 5 | 8 | 0 | 21 |
| Тиоридазин | 22 | 24 | 34 | 0 | 80 |
| Трифлуоперазин | 15 | 5 | 13 | 1 | 34 |
| Флупентиксол | 7 | 2 | 4 | 0 | 13 |
| Флуфеназин | 2 | 1 | 1 | 2 | 6 |
| Хлорпромазин | 41 | 26 | 48 | 2 | 117 |
| Хлорпротиксен | 26 | 53 | 33 | 1 | 113 |
| Итого | 388 | 199 | 287 | 22 | 896 |
| Атипичные | |||||
| Амисульприд | 4 | 2 | 5 | 0 | 11 |
| Арипипразол | 10 | 3 | 4 | 0 | 17 |
| Зипрасидон | 1 | 3 | 6 | 0 | 10 |
| Кветиапин | 60 | 55 | 43 | 2 | 160 |
| Клозапин | 42 | 50 | 30 | 4 | 126 |
| Луразидон | 5 | 5 | 6 | 0 | 16 |
| Оланзапин | 24 | 22 | 35 | 1 | 82 |
| Палиперидон | 22 | 18 | 32 | 1 | 73 |
| Рисперидон | 99 | 27 | 128 | 2 | 256 |
| Сертиндол | 2 | 2 | 6 | 0 | 10 |
| Сульпирид | 15 | 10 | 21 | 0 | 46 |
| Тиаприд | 3 | 2 | 0 | 0 | 5 |
| Итого | 287 | 199 | 316 | 10 | 812 |
Как видно из таблицы, для типичных антипсихотиков наиболее часто направляются спонтанные сообщения о неврологических (388 спонтанных сообщений, 43,31%) и соматических НЛР (287 спонтанных сообщений, 32,04%). Среди неврологических НЛР преобладали экстрапирамиданые расстройства; также часто регистрировались вегетативные нарушения и судорожная готовность. На долю НЛР со стороны психики приходится 22,21% от общего числа спонтанных сообщений, зарегистрированных для всех типичных антипсихотических ЛС. Кроме того, зарегистрированы 22 спонтанных сообщения о возникновении злокачественного нейролептического синдрома (2,46% от всех спонтанных сообщений, полученных для типичных антипсихотиков), преимущественно на фоне применения галоперидола (10 спонтанных сообщений или 45,46%).
При применении атипичных антипсихотических ЛС чаще всего регистрировали соматические (316 спонтанных сообщений, 38,92% от общего количества спонтанных сообщений, полученных для атипичных антипсихотиков) и неврологические НЛР (287 спонтанных сообщений, 35,35%). Доля психических НЛР составила 24,51%. Зарегистрированы 10 спонтанных сообщений о развитии злокачественного нейролептического синдрома (4 – на фоне применения клозапина). В структуре соматических НЛР, возникавших на фоне назначения атипичных антипсихотиков, преобладали эндокринные и метаболические нарушения: гиперпролактинемия, галакторея, аменорея, нарушения менструального цикла, сексуальная дисфункция, а также увеличение массы тела, повышение уровня триглицеридов, глюкозы и холестерина в крови.
К зарегистрированным экстрапирамидным расстройствам при применении обеих групп антипсихотических ЛС чаще всего относились проявления паркинсонизма, острой дистонии, акатизии и поздней дискинезии. Отправители спонтанных сообщений описывали эти симптомы как мышечную скованность, ригидность или напряженность, гипертонус, тремор, паркинсонизм, брадикинезию, экстрапирамидные нарушения, окулогирные кризы и неусидчивость. Экстрапирамидные расстройства чаще всего регистрировались при применении типичных антипсихотических ЛС, а также рисперидона и кветиапина.
Доля НЛР типа В (реакции гиперчувствительности) составила 6,24% для всех антипсихотических ЛС. Преобладали НЛР типа А, т.е. предсказуемые дозозависимые нежелательные реакции, связанные с фармакологической активностью ЛС.
Далее был проведен анализ исходов НЛР (табл. 5). Чаще всего среди известных исходов регистрировались "выздоровление без последствий" и "улучшение состояния". Самым редким исходом было "выздоровление с последствиями".
| Антипсихотики, МНН | Смерть | Выздоро вление с последствиями | Без изменений | Улучшение | Выздоро вление без последствий | Нет данных | Итого |
|---|---|---|---|---|---|---|---|
| Типичные | |||||||
| Алимемазина тартрат | 0 | 0 | 0 | 0 | 0 | 2 | 2 |
| Галоперидол | 5 | 4 | 11 | 109 | 118 | 18 | 265 |
| Дроперидол | 1 | 0 | 0 | 1 | 7 | 1 | 10 |
| Зуклопентиксол | 0 | 0 | 5 | 27 | 24 | 4 | 60 |
| Левомепромазин | 1 | 0 | 6 | 11 | 30 | 4 | 52 |
| Перициазин | 0 | 1 | 2 | 28 | 68 | 7 | 106 |
| Перфеназин | 0 | 0 | 0 | 4 | 14 | 1 | 19 |
| Тиоридазин | 0 | 0 | 1 | 23 | 46 | 10 | 80 |
| Трифлуоперазин | 0 | 0 | 3 | 13 | 15 | 1 | 32 |
| Флупентиксол | 0 | 0 | 1 | 5 | 4 | 3 | 13 |
| Флуфеназин | 0 | 1 | 2 | 2 | 1 | 0 | 6 |
| Хлорпромазин | 0 | 10 | 0 | 45 | 53 | 7 | 115 |
| Хлорпротиксен | 1 | 0 | 4 | 39 | 39 | 20 | 112 |
| Итого | 8 | 16 | 35 | 307 | 428 | 78 | 872 |
| Атипичные | |||||||
| Амисульприд | 0 | 0 | 3 | 3 | 5 | 0 | 11 |
| Арипипразол | 0 | 0 | 0 | 5 | 9 | 3 | 11 |
| Зипрасидон | 1 | 0 | 1 | 1 | 1 | 6 | 10 |
| Кветиапин | 0 | 0 | 12 | 64 | 59 | 25 | 160 |
| Клозапин | 3 | 0 | 13 | 39 | 50 | 20 | 125 |
| Луразидон | 0 | 0 | 3 | 3 | 9 | 1 | 16 |
| Оланзапин | 0 | 1 | 15 | 26 | 24 | 16 | 82 |
| Палиперидон | 1 | 1 | 9 | 15 | 39 | 8 | 73 |
| Рисперидон | 1 | 1 | 43 | 79 | 114 | 18 | 256 |
| Сертиндол | 0 | 0 | 1 | 5 | 3 | 1 | 10 |
| Сульпирид | 0 | 0 | 0 | 2 | 3 | 0 | 5 |
| Тиаприд | 0 | 0 | 0 | 2 | 3 | 0 | 5 |
| Итого | 6 | 3 | 105 | 255 | 338 | 104 | 811 |
Обсуждение
При анализе структуры НЛР установлено, что частота нейролептических экстрапирамидных расстройства остается высокой, особенно при назначении типичных антипсихотических ЛС. Это может быть обусловлено как фармакологическими свойствами отдельных лекарственных веществ, так и сложившимися стереотипами назначения нейролептиков. Лекарственно-индуцированные экстрапирамидные расстройства – ятрогенная нежелательная реакция со стороны экстрапирамидной системы, чаще всего развивающаяся на фоне приема ЛС, изменяющих активность дофаминергической системы [19]. Они представляют собой комплекс двигательных нарушений, возникающих в результате изменения функции преимущественно базальных ганглиев [20]. Согласно опубликованным данным, с приемом ЛС связывают от 4 до 22% всех случаев паркинсонизма [21]. Экстрапирамидные расстройства могут стигматизировать пациентов и вызвать у них субъективный дистресс и снижение приверженности к лечению, а также затруднять клиническую оценку негативных симптомов шизофрении [22]. Развитие экстрапирамидных расстройств в большинстве случаев требует снижения дозы нейролептика и назначения препаратов-корректоров [23].
Острые экстрапирамидные расстройства возникают в течение нескольких дней или недель после начала приема антипсихотика или увеличения его дозы, в то время как поздние могут развиться спустя нескольких месяцев или даже лет после начала лечения [24]. Предполагается, что причиной поздней дискинезии является относительный холинергический дефицит, вторичный по отношению к гиперчувствительности дофаминовых рецепторов в стриатуме (конкретнее – в неостриатуме, т.е. хвостатом ядре и скорлупе). В целом, предполагаемые механизмы, лежащие в основе этих побочных явлений, включают снижение концентрации дофамина в стриатуме и гиперчувствительность к дофамину при лекарственно-индуцированном паркинсонизме и поздней дискинезии, соответственно [25]. Для лечения лекарственного паркинсонизма обычно применяют антихолинергические средства центрального действия, такие как тригексифенидил и бипериден, однако антихолинергические препараты могут ухудшить течение поздней дискинезии. Поэтому лучше заменить антипсихотические ЛС на препараты, которые реже вызывают паркинсонизм и позднюю дискинезию [22].
При анализе мы выявили спонтанные сообщения о развитии злокачественного нейролептического синдрома, который является редкой, но опасной для жизни ятрогенной НЛР, наблюдающейся на фоне приема антипсихотиков [26]. Частота его у пациентов, получающих антипсихотики, варьируется от 0,02 до 3,23% [27]. Хотя злокачественный нейролептический синдром может развиться при применении как типичных, так и атипичных нейролептиков, наиболее сильная ассоциация установлена с галоперидолом вследствие его высокой аффинности к D2-дофаминовым рецепторам [26]. В нашем исследовании частота развития злокачественного нейролептического синдрома была выше при назначении типичных антипсихотиков. Чаще всего он наблюдался при применении галоперидола и зуклопентиксола из группы типичных антипсихотиков, а также клозапина, кветиапина и рисперидона из группы атипичных антипсихотических ЛС. Однако интерпретировать полученные данные следует осторожно, так как в большинстве сообщений пациенты получали более одного ЛС и делать однозначные выводы о причинноследственных связях не всегда возможно.
Среди НЛР, зарегистрированных при применении атипичных антипсихотических ЛС, преобладали соматические, особенно эндокринные и метаболические нарушения. Действительно, в опубликованных работах достаточно давно предполагалось, что связывание и блокирование 5-НТ2C-гистаминовых рецепторов может быть причиной частого повышения массы тела при применении антипсихотических ЛС второго поколения [28,29]. Установлено, что стимуляция 5-НТ2C рецепторов приводит к изменению пищевого поведения у животных в форме уменьшения объема потребляемой пищи [30]. Соответственно, антагонисты этих рецепторов, в том числе большинство антипсихотических ЛС второго поколения, вызывают увеличение объема потребляемой пищи и как следствие, массы тела.
В целом, зарегистрированные спонтанные сообщения соответствовали общему спектру НЛР, характерных для отдельных представителей антипсихотических ЛС. Интерпретируя полученные результаты, важно помнить о том, что данные для анализа были получены методом спонтанных сообщений в условиях реальной клинической практики. Это означает, что к полученным результатам применимы те же ограничения, которые присущи методу спонтанных сообщений. Таким образом, нами приводится не истинная частота возникновения НЛР на фоне терапии исследуемыми ЛС, а частота репортирования о них. Например, клиницисты могли расценить НЛР как не подлежащие сообщению регуляторным органам или связанные с назначением других ЛС. Тем не менее, проведенное исследование позволяет выделить наиболее часто репортируемые НЛР и сохранить настороженность в отношении проблем безопасности антипсихотических ЛС в целом.
Заключение
Результаты ретроспективного фармакоэпидемиологического анализа показали, что НЛР остаются актуальной проблемой терапии пациентов, нуждающихся в приеме антипсихотических ЛС. Среди НЛР, зарегистрированных при применении типичных антипсихотиков, преобладали экстрапирамидные расстройства, в то время как для атипичных антипсихотиков наиболее характерными нежелательными реакциями были соматические, в частности, эндокринные и метаболические нарушения. Полученные нами результаты в целом соответствуют современным представлениям о безопасности исследуемых ЛС.
Большинство зарегистрированных НЛР являются дозозависимыми и предсказуемыми. Для предотвращения их развития целесообразно применение персонализированного подхода к назначению антипсихотических ЛС с целью повышения безопасности терапии. Это подтверждается современными публикациями, согласно которым персонализированное назначение психотропных ЛС (в частности, с применением фармакогенетических исследований) позволяет повысить безопасность антипсихотической терапии [31].
Используемые источники
- Khalil H, Huang C. Adverse drug reactions in primary care: a scoping review. BMC Health Serv Res 2020;20(1):5.
- Sultana J, Cutroneo P, TrifirШ G. Clinical and economic burden of adverse drug reactions. J Pharmacol Pharmacother 2013;4(Suppl 1):S73-7.
- Louët HL, Pitts PJ. Twenty-first century global ADR management: a need for clarification, redesign, and coordinated action. Ther Innov Regul Sci 2023;57(1):100-3.
- Lee JY, Ang ASY, Mohd Ali N, et al. Incidence of adverse reaction of drugs used in COVID-19 management: a retrospective, observational study. J Pharm Policy Pract 2021;14(1):84.
- Остроумова О.Д., Голобородова И.В., Исаев Р.И., Переверзев А.П. Антипсихотики: особенности нежелательных побочных реакций у лиц пожилого и старческого возраста. Журнал неврологии и психиатрии им. С.С. Корсакова 2019;119(2):105-17 [Ostroumova OD, Goloborodova IV, Isaev RI, Pereverzev AP. Antipsychotics: features of adverse reactions in the. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2019;119(2):105-117 (In Russ.)].
- McIntyre RS, Berk M, Brietzke E, et al. Bipolar disorders. Lancet 2020;396:1841-56.
- Nuñez NA, Joseph B, Pahwa M, et al. Augmentation strategies for treatment resistant major depression: A systematic review and network meta-analysis. J Affect Disord 2022;302:385-400.
- Ames D, Carr-Lopez SM, Gutierrez MA, et al. Detecting and managing adverse effects of antipsychotic medications: current state of play. Psychiatr Clin North Am 2016;39(2):275-311.
- Guo K, Feng Z, Chen S, et al. Safety profile of antipsychotic drugs: analysis based on a provincial spontaneous reporting systems database. Front Pharmacol 2022;13:848472.
- Giardina C, Cutroneo PM, Mocciaro E, et al. Adverse drug reactions in hospitalized patients: results of the FORWARD (Facilitation of Reporting in Hospital Ward) Study. Front Pharmacol 2018;9:350.
- Мильчаков К.С. Рекомендации по мониторингу информации о безопасности и эффективности лекарственных препаратов в РФ в контексте фармаконадзора. Безопасность и риск фармакотерапии 2022;10(3):218–29 [Mil' cha kov KS. Recommendations for monitoring information on the safety and efficacy of medicines in the Russian Federation in the context of pharmacovigilance. Safety and risk of pharmacotherapy 2022;10(3):218–29 (In Russ.)].
- Казаков А.С., Дармостукова М.А., Букатина Т.М. и др. Сравнительный анализ международных баз данных о нежелательных реакциях лекарственных средств. Безопасность и риск фармакотерапии 2020;8(3):134-40 [Kazakov AS, Darmostukova MA, Bukatina TM, et al. Comparative analysis of international databases on adverse drug reactions. Safety and risk of pharmacotherapy 2020;8(3):134–40 (In Russ.)].
- Watson S, Chandler R, Taavola H, et al. Safety concerns reported by patients identified in a Collaborative Signal Detection Workshop using VigiBase: results and reflections from Lareb and Uppsala Monitoring Centre. Drug Saf 2018;41(2):203-12.
- Перова Н.Н., Рябчунова Л.В., Головина В.Н. Развитие службы фармаконадзора в медицинских организациях. Многопрофильный стационар 2019;6(1):37-43 [Perova NN, Rjabchunova LV, Golovina VN. Development of pharmacovigilance services in health-care organisations. Mnogoprofil'nyj stacionar 2019;6(1):37–43 (In Russ.)].
- Костылева М.Н., Белоусов Ю.Б., Грацианская А.Н., Постников С.С. Оценка безопасности лекарственной терапии в клинической практике. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология 2014;7(1):26-31 [Kostyleva MN, Belousov JuB, Gracianskaja AN, Postnikov SS. Assessing the safety of drug therapy in clinical practice. Pharmacoeconomics. Modern pharmacoeconomics and pharmacoepidemiology 2014;7(1):26–31 (In Russ.)].
- Глаголев С.В., Поливанов В.А., Чижова Д.А., Горелов К.В. Мониторинг безопасности лекарственных средств: состояние и перспективы. Вестник Росздравнадзора 2013;4:17-20 [Glagolev SV, Polivanov VA, Chizhova DA, Gorelov KV. Drug safety monitoring: status and prospects. Bulletin of Roszdravnadzor 2013;4:17–20. (In Russ.)].
- Меркулов В.А., Бунятян Н.Д., Лепахин В.К. и др. Оценка нежелательных реакций при применении лекарственных средств в России в 2013 году. Безопасность и риск фармакотерапии 2014;1:31-41 [Merkulov VA, Bunjatjan ND, Lepahin VK, et al. Assessment of adverse drug reactions in Russia in 2013. Safety and risk of pharmacotherapy 2014;1:31–41. (In Russ.)].
- Малин Д.И. Побочное действие психотропных средств. М.: Вузовская книга, 2000, 208 с.
- Вайман Е.Э., Шнайдер Н.А., Незнанов Н.Г., Насырова Р.Ф. Методы диагностики антипсихотик-индуцированных экстрапирамидных расстройств. Сибирское медицинское обозрение 2019;5:5-13 [Vajman EJe, Shnajder NA, Neznanov NG, Nasyrova RF. Diagnostic methods for antipsychotic-induced extrapyramidal disorders. Siberian Medical Review 2019;5(119):5–13 (In Russ.)].
- Маслов К.А. Корректоры лекарственно-индуцированных экстрапирамидных расстройств в россии, в современной клинической практике врачапсихиатра. Вопросы прикладного практического применения. Психиатрия и психофармакотерапия 2022;24(1):26-32 [Maslov KA. Correctors of druginduced extrapyramidal disorders in russia, in modern clinical practice of the psychiatrist. Psychiatry and Psychopharmacotherapy 2022;24(1):26–32 (In Russ.)].
- Васильев Ю.Н., Быков Ю.Н., Бендер Т.Б. Экстрапирамидные расстройства: учебное пособие для врачей. Иркутск: ИГМУ, 2018, 84 с.
- Ali T, Sisay M, Tariku M, et al. Antipsychotic-induced extrapyramidal side effects: A systematic review and meta-analysis of observational studies. PLoS One 2021;16(9):e0257129.
- Бурашникова И.С., Миннекеева К.А., Сычев Д.А. и др. Сравнительный анализ нежелательных реакций при применении типичных и атипичных антипсихотиков. Вестник Росздравнадзора 2016;5:109-13 [Burashnikova IS, Minnekeeva KA, Sychev DA, et al. Comparative analysis of adverse reactions when using typical and atypical antipsychotics. Bulletin of Roszdravnadzor 2016;5:109–13 (In Russ.)].
- Halterman MW. Drug induced movement disorders. Neurology 2006;67:1728-9.
- Ward KM, Citrome L. Antipsychotic-related movement disorders: drug-induced parkinsonism vs. tardive dyskinesia – key differences in pathophysiology and clinical management. Neurol Ther 2018;7(2):233-48.
- Вайман Е.Э., Шнайдер Н.А., Архипов В.В., Насырова Р.Ф. Злокачественный нейролептический синдром. Современная терапия психических расстройств 2020;4:13-21.
- Velamoor R. Neuroleptic malignant syndrome: A neuro-psychiatric emergency: Recognition, prevention, and management. Asian J Psychiatr 2017;29:106-9.
- Reynolds GP. Association of antipsychotic drug-induced weight gain with a 5-HT2C receptor gene polymorphism. J Psychopharmacol 2004;18:340-5.
- Adan RA, Vanderschuren LJ, la Fleur SE. Anti-obesity drugs and neural circuits of feeding. Trends Pharmacol Sci 2008;29:208-17.
- Lencz T, Malhotra AK. Pharmacogenetics of antipsychotic-induced side effects. Dialogues Clin Neurosci 2009;11(4):405-15.
- Arranz MJ, Gonzalez-Rodriguez A, Perez-Blanco J, et al. A pharmacogenetic intervention for the improvement of the safety profile of antipsychotic treatments. Transl Psychiatry 2019;9(1):177.
