Гипофосфатазия у взрослых: как не пропустить редкий диагноз?
Гипофосфатазия (ГФФ) – это редкое наследственное заболевание, характеризующееся снижением активности тканенеспецифической щелочной фосфатазы (ЩФ) в результате мутаций гена ALPL, нарушением минерализации костей (остеомаляцией) и скелетномышечными проявлениями (деформация костей, повторные переломы, выпадение зубов, боли в костях и мышцах, снижение мышечной силы). Основной лабораторный признак ГФФ – стойкое снижение активности ЩФ ниже возрастной нормы, которое приводит к накоплению неорганического пирофосфата, подавляющего минерализацию костей. Более выраженное снижение активности ЩФ и тяжелое течение ГФФ наблюдаются при наличии гомозиготных и компаунд-гетерозиготных вариантов гена ALPL, однако клинические проявления заболевания отмечаются и при наличии гетерозиготных мутаций. В статье на примере двух наблюдений обсуждаются проявления ГФФ у взрослых пациентов и эффективность ферментозаместительной терапии рекомбинантным аналогом ЩФ – асфотазой альфа, которая вызывала увеличение выживаемости у детей с перинатальной и инфантильной формами заболевания и улучшала показатели функциональной активности и качества жизни у взрослых пациентов.
Моисеев С.В. Гипофосфатазия (ГФФ) – это редкое наследственное заболевание, обусловленное мутациями гена ALPL и характеризующееся снижением активности тканенеспецифической щелочной фосфатазы (ЩФ), которая экспрессируется в различных тканях. ЩФ представляет собой семейство изоферментов, которые отличаются по физикохимическим свойствам и выполняют различные функции, в частности участвуют в регуляции минерализации костной ткани, поэтому в клинической картине ГФФ преобладают скелетно-мышечные проявления (рахит, остеомаляция, переломы, боли в костях и мышцах и др.) [1].
В настоящее время известно более 400 мутаций гена ALPL (преимущественно миссенс), которые передаются по аутосомно-доминантному или аутосомно-рецессивному типу [3]. Помимо двух типов наследования, ГФФ характеризуется неполной пенетрантностью доминантных вариантов гена и значительной вариабельностью фенотипической экспрессии, в том числе у членов одной семьи [4]. Более тяжелые формы заболевания связаны с более значительным снижением активности ЩФ и наличием гомозиготных или компаунд-гетерозиготных мутаций гена ALPL. При гетерозиготных мутациях симптомы ГФФ обычно менее выраженные или отсутствуют.
В зависимости от возраста, в котором появляются симптомы ГФФ, выделяют перинатальную (развитие симптомов внутриутробно или при рождении), младенческую, или инфантильную (до 6-месячного возраста), детскую (6 мес — 18 лет) и взрослую формы заболевания [5]. Отдельно рассматривают одонтогипофосфатазию, при которой наблюдается только поражение зубов. Как правило, тяжесть течения ГФФ зависит от формы болезни – от самого тяжелого при перинатальной форме до относительно легкого при взрослой. Тем не менее, целесообразность разделения ГФФ на детскую и взрослую форму вызывает определенные сомнения, так как, с одной стороны, при постепенном прогрессировании заболевания у взрослых нередко бывает трудно определить, когда появились первые симптомы, а, с другой стороны, некоторые часто встречающиеся проявления ГФФ, например, повторные плохо заживающие переломы, могут привести к инвалидизации пациентов. В классификации наследственных скелетных заболеваний, пересмотренной в 2023 г., предлагается выделять аутосомно-рецессивную (перинатальную, инфантильную, ювенильную) и аутосомно-доминантную (ювенильную, взрослую, одонто) формы ГФФ [6].
Какова распространенность ГФФ? Каковы механизмы ее развития?
Чеботарева Н.В.Точных данных о распространенности ГФФ, как и многих других орфанных болезней, нет.-Самый высокий показатель зарегистрирован у представителей меннонитской общины в Манитобе (Канада), в-которой доля носителей варианта гена ALPL составила-4%, а летальная форма ГФФ развивалась примерно у-1 из 2500 новорожденных [7]. Во Франции частота-тяжелых форм ГФФ, которую оценивали на основании-количества зарегистрированных случаев, составила-около 1:300 000, однако, по данным авторов, расчетная-распространенность среднетяжелой ГФФ в Европе-может достигать 1:6370 [8], т.е. ГФФ, вероятно, встречается значительно чаще, чем принято считать. Это-неудивительно, так как менее тяжелые формы любых-орфанных заболеваний нередко остаются нераспознанными, особенно у взрослых пациентов, у которых врачи-обычно не обсуждают возможный наследственный-генез имеющихся нарушений.
У человека синтез ЩФ кодируется четырьмя генами (ALPI, ALPP, ALPPL2 и ALPL) [9]. Три первых изофермента экспрессируются в кишечнике, плаценте и зародышевых клетках, т.е. являются тканеспецифическими, в то время как один изофермент, кодируемый геном ALPL, содержится во многих тканях, включая кости, печень, почки и зубы. ЩФ представляет собой дефосфорилазу, которая отщепляет фосфат от различных молекул, поэтому снижение активности фермента при мутациях гена ALPL приводит к накоплению трех основных метаболитов – неорганического фосфата, пиридоксаль 5’-фосфата (активной формы витамина В6) и фосфоэтаноламина. Лучше всего известны неблагоприятные эффекты неорганического фосфата, который является мощным ингибитором минерализации костной ткани. Кроме того, нарушение его расщепления сопровождается уменьшением образования фосфата, который связывается с кальцием с образованием кристаллов гидроксиапатита, необходимых для увеличения минеральной плотности костей. Остеомаляция при ГФФ увеличивает риск переломов и может привести к эктопической кальцификации тканей, в частности развитию нефрокальциноза. Отложение кристаллов пирофосфата кальция, образующихся при соединении неорганического фосфата с аморфным фосфатом кальция, в суставном хряще может быть причиной псевдоподагры.
Дефосфорилирование пиридоксаль 5’-фосфата под действием ЩФ обеспечивает его проникновение через клеточную оболочку в цитоплазму, где пиридоксаль вновь фосфорилируется и участвует в различных ферментативных реакциях в качестве кофактора. Нарушение дефосфорилирования пиридоксаль 5’-фосфата при тяжелой ГФФ может быть причиной образования гамма-аминомасляной кислоты (ингибирующего нейромедиатора) и развития судорог, купирующихся витамином В6.
Возможные эффекты накопления фосфоэтаноламина при недостаточной активности ЩФ не установлены.
Моисеев С.В. Основные клинические проявления ГФФ перечислены в табл. 1. Как указано выше, спектр их и выраженность симптомов варьируются в широких пределах. Наиболее тяжелое течение, часто с летальным исходом, отмечается при перинатальной и инфантильной формах ГФФ, которые характеруются выраженной гипоминерализацией костной ткани, деформацией скелета, гипоплазией легких, которая может потребовать респираторной поддержки, витамин В6-зависимыми судорогами, мышечной гипотонией, болями в мышцах и костях. У детей с ГФФ часто наблюдается краниосиностоз – раннее закрытие черепных швов, которое ограничивает объем черепа и вызывает его деформацию и внутричерепную гипертензию.
| Системы органов | Проявления |
|---|---|
| Скелет | Рахит, деформация костей, остеомаляция/остеопороз, переломы, низкий рост, замедленное заживление переломов, краниосиностоз, боль в костях |
| Мышцы | Снижение силы мышц, нарушение походки,миалгии |
| Нервная система | Судороги, осложнения краниосиностоза, в частности внутричерепная гипертония |
| Система дыхания | Деформация грудной клетки, гипоплазия легких, частые инфекции дыхательных путей,трахеомаляция |
| Почки | Нефролитиаз, нефрокальциноз |
| Суставы | Хондрокальциноз/псевдоподагра, периартикулярная кальцификация |
| Зубы | Раннее выпадение зубов |
Как проявляется ГФФ у взрослых? Когда следует подозревать этот диагноз?
Моисеев А.С. Заподозрить ГФФ у взрослых бывает сложно, учитывая постепенное нарастание симптомов, неспецифичность некоторых проявлений, прежде всего болей в костях и мышцах, и отсутствие выраженной остеомаляции костей и их рахитической деформации, которая обычно наблюдается у детей. Ключевым лабораторным признаком ГФФ является снижение активности ЩФ, которое может быть пограничным или умеренным, что затрудняет интерпретацию выявленных изменений. Частое проявление ГФФ у взрослых – повторные переломы преимущественно костей нижних конечностей, что иллюстрирует следующее наблюдение.
Пациентка К., 55 лет, обратилась в клинику им. Е.М. Та реева летом 2023 года. В течение жизни перенесла 8 переломов различных костей нижних конечностей, в том числе 4 – на протяжении последних 6 лет (включая шейку левого бедра). В возрасте 49 лет впервые выявлено снижение активности ЩФ до 23 ед/мл, которое сохранялось и в последующих лабораторных анализах, однако врачи не придавали значения отклонению этого показателя от нормы. При денситометрии определялись признаки умеренной остеопении. На основании информации из интернет пациентка сама заподозрила диагноз ГФФ. При молекулярно-генетическом исследовании в июне 2023 года выявлена миссенс-мутация в экзоне 4 гена ALPL (c.211C>T) в гетерозиготном состоянии. Для данной мутации описан доминантно-негативный эффект, т.е. для фенотипического проявления подобного варианта гена достаточно его присутствия в гетерозиготном состоянии. Установлен диагноз ГФФ.
Таким образом, у 55-летней пациентки на протяжении жизни было зафиксировано 8 переломов, которые нельзя было объяснить остеопорозом, учитывая умеренное снижение минеральной плотности костной ткани, выявленное при денситометрии. Диагноз ГФФ подтверждался стойким снижением активности ЩФ и наличием мутации гена ALPL.
Повторные переломы костей, которые сопровождаются временной нетрудоспособностью и могут быть причиной инвалидизации, – ведущее проявление ГФФ у взрослых пациентов. Признаком остеомаляции могут быть также псевдопереломы (зоны Лоозера) шейки бедренной кости, диафизов длинных трубчатых и других костей, которые на рентгенограмме характеризуются наличием клиновидной полосы просветления шириной несколько миллиметров, расположенной поперечно длиннику кости (рис. 1) [3]. В отличие от перелома, при псевдопереломах отсутствуют травма, смещение отломков костей, гематома, крепитация и сохранена опорная функция поврежденной кости.
![Псевдопереломы бедренной и большеберцовой костей [3]](/img/articles/2023.4/gipofosfataziya-u-vzroslyh-kak-ne-propustit-redkij-diagnoz_fig1.jpg)
L. Seefried и соавт. проанализировали клинические проявления у 304 пациентов в возрасте старше 18 лет с ГФФ (медиана возраста 48,6 лет, 74% женщин), включенных в Международный регистр [10]. У 45% из них имелась взрослая форма ГФФ, а у 33% – детская, однако у каждого пятого пациента точно определить возраст, когда появились симптомы заболевания, не удалось. По крайней один перелом/псевдоперелом наблюдался у 62% пациентов, а 3 и более переломов – у 22%. Доля пациентов, перенесших по крайней мере 1 или 3 перелома/псевдоперелома, среди больных с детской формой ГФФ была выше (72% и 31%, соответственно), чем со взрослой формой заболевания (57% и 18%, соответственно), однако медиана числа переломов на пациента была одинаковой в двух группах – 2,0 (1,0, 12,0) и 2,0 (1,0, 21,0), как и необходимость в хирургических вмешательствах (33% и 29%).
Другими частыми проявлениями ГФФ у взрослых в этом исследовании были боли в костях и мышцах, которые в трети случаев требовали применения анальгетиков, в том числе опиоидных, выпадение зубов и мышечная слабость.
Моисеев С.В. Исключать ГФФ необходимо в тех случаях, когда типичные клинические проявления сочетаются со стойким снижением активности ЩФ. В первую очередь, конечно, необходимо повторить лабораторный анализ, чтобы убедиться в том, что выявленные изменения не являются случайными. Каковы возможные причины стойкого снижения активности ЩФ в клинической практике?
Шоломова В.И. Активность ЩФ зависит от возраста – она выше у детей и подростков, а также у беременных женщин. У взрослых нижняя границы нормы для активности ЩФ составляет 35-40 ед/л. Снижение активности ЩФ нередко наблюдается у взрослых людей. T. Schmidt и соавт. проанализировали результаты почти 7 млн измерений активности фермента, выполненных в лаборатории за 5-летний период [11]. Частота однократного снижения активности ШФ менее 30 ед/л у людей в возрасте старше 18 лет составила 8,5% и была одинаковой у мужчин и женщин. Еще у 9,5% обследованных активность ШФ находилась в диапазоне от 30 до 40 ед/л. Авторы не оценивали результаты повторных лабораторных исследований, а также возможные причины снижения активности фермента. Тем не менее, они проанализировали результаты одновременного измерения содержания пиридоксаль 5’-фосфата, которое проводилось у части пациентов. Повышение уровня активной формы витамина В было выявлено у 210 (6,1%) пациентов с активностью ЩФ ниже 30 ед/л. Полученные данные позволили рассчитать возможную частоту лабораторных признаков ГФФ в общей популяции, которая составила около 0,5%.
Частой причиной снижения активности ЩФ в клинической практике является гипотиреоз [12]. Кроме того, активность фермента может быть снижена при лечении бисфосфонатами, болезни Кушинга, интоксикации витамином D, болезни Вильсона-Коновалова, целиакии, адинамической почечной остеодистрофии, дефиците цинка.
В ряде исследований изучалась частота снижения активности ЩФ и ГФФ среди пациентов, обращавшихся к эндокринологам или ревматологам. В одном из таких исследований были проанализированы результаты измерения активности ЩФ более чем у 26000 пациентов, обследованных в эндокринологическом отделении университетской больницы в Копенгагене (Дания) [13]. Персистирующее снижение активности фермента <35 ед/л было выявлено в 0,2% случаев. Среди 24 пациентов с низкой активностью ЩФ, которым проводилось молекулярно-генетическое исследование, ГФФ была диагностирована в 13 (54,2%) случаях на основании наличия патогенных мутаций гена ALPL в сочетании с характерными клиническими симптомами (хроническая боль в мышцах, костях и суставах, мышечная слабость и/или переломы). Следует отметить, что у части пациентов с ГФФ имелись дополнительные причины снижения активности ЩФ – гипотиреоз или прием антирезорбтивных препаратов. Приведенные данные свидетельствуют о том, что если у пациента с низкой активностью ЩФ клинические проявления указывают на возможность ГФФ, то исключать этот диагноз следует даже при наличии альтернативных причин снижения активности фермента, тем более что в России необходимое генетическое исследование может быть выполнено бесплатно в любом регионе страны.
В другом исследовании были проанализированы результаты измерения активности ЩФ за 10-летний период у 9522 пациентов, обращавшихся к ревматологу [14]. Низкая активность фермента (<40 ед/л) определялась в 524 (5,5%) случаях. Большинство пациентов были исключены из исследования, учитывая преходящее повышение активности ЩФ, вторичный его генез, отсутствие симптомов ГФФ. Дополнительными основаниями для генетического теста служили (1) отсутствие определенного ревматологического диагноза; (2) неоднозначные диагнозы, такие как фибромиалгия, боль в нижней части спины, кальфицирующий тендинит, остеоартрит и др.; (3) неэффективность проводимой терапии. Молекулярно-генетическое исследование было проведено у 23 пациентов с предполагаемой ГФФ, а мутации гена ALPL были выявлены в 13 (57%) случаях. Сходные данные были получены и в других похожих исследованиях [15].
Таким образом, снижение активности ЩФ ниже 3035 ед/л – это достаточно частая находка при биохимическом анализе крови у взрослых людей. В большинстве случаев снижение активности фермента оказывается преходящим или обусловлено не ГФФ, а другими причинами, такими как гипотиреоз. Соответственно, исключать наследственный генез снижения активности ЩФ следует только при стойком отклонении этого показателя от нормы при наличии клинических проявлений, указывающих на ГФФ. Необходимо учитывать, что нормальная активность ЩФ при ГФФ может быть обусловлена повышением содержания этого фермента при некоторых состояниях, в частности во время беременности, при холестазе или заживлении переломов.
Моисеев С.В. Результаты скрининговых исследований свидетельствуют о том, что частыми "масками" ГФФ являются ревматологические диагнозы. Как не пропустить этот диагноз ревматологу?
Новиков П.И. Хроническая боль в мышцах и/или костях, часто распространенная, отмечается у двух третей взрослых пациентов с ГФФ и нередко требует регулярного приема анальгетиков, в том числе опиоидных [10]. Помимо боли, встречаются мышечная слабость, утомляемость, нарушение походки. K. Dahir и соавт. проанализировали клинические проявления у 141 пациента со взрослой формой ГФФ, включенных в Международный регистр [16]. Любая хроническая боль наблюдалась у 64,5% из них, хроническая боль в костях – у 52,5%, генерализованная боль – у 22,0%, хроническая боль в мышцах – у 19,1%, утомляемость – у 23,4%, мышечная слабость – у 17,0%, нарушение походки – у 5,7%. У взрослых боль и/или мышечные симптомы обычно сочетаются с различными изменениями скелета, прежде всего переломами костей, однако последние могут и отсутствовать [17].
Перечисленные выше проявления ГФФ неспецифичны и могут быть обусловлены различными причинами. Например, по данным мета-анализа клинических исследований, в общей популяции у 140 000 жителей Великобритании частота хронической боли варьировалась от 35,0% до 51,3%. Она была выше у женщин и увеличивалась с 14,3% в возрасте 18-25 лет до 62,0% в возрасте старше 75 лет. При этом у молодых людей (1839 лет) частота хронической боли достигала 30% [18].
Клиническая картина ГФФ не характерна для системных иммуновоспалительных ревматических заболеваний, таких как ревматоидный артрит, системная красная волчанка, идиопатические воспалительные миопатии и др., учитывая постепенное нарастание симптомов, отсутствие клинических и лабораторных признаков воспалительной активности и аутоантител (ревматоидный фактор, антинуклеарный фактор и т.п.). Однако пирофосфатная артропатия, иногда развивающаяся при ГФФ, может имитировать клиническую картину ревматоидного или псориатического артрита и ревматической полимиалгии. Как уже подчеркивалось выше, диагноз ГФФ следует обсуждать при снижении активности ЩФ, хотя, как показало и наше наблюдение, врачи могут не обращать внимание на снижение этого показателя (в отличие от его повышения).
Моисеев С.В. У 5-10% пациентов с ГФФ, включенных в Международный регистр, наблюдались хондрокальциноз и псевдоподагра [16]. Каковы современные подходы к диагностике этих состояний?
Новиков П.И. Хондрокальциноз – это кальцификация суставного хряща (чаще всего коленных суставов, реже лучезапястных и тазобедренных), которая определяется при рентгенографии у 7-10% людей старше 60 лет [19] и чаще всего обусловлена отложением кристаллов пирофосфата кальция. Хондрокальциноз представляет собой рентгенологический феномен, поэтому эксперты EULAR для обозначения соответствующей нозологической формы рекомендовали использовать термин "болезнь отложения кристаллов пирофосфата кальция" [20]. В нашей стране это заболевание обычно называют пирофосфатной артропатией. Недавно были опубликованы классификационные критерии болезни отложения кристаллов пирофосфата кальция, предложенные Американской коллегией ревматологов и EULAR и предполагающие балльную оценку клинических проявлений, результатов анализа синовиальной жидкости и визуализирующих методов, в том числе рентгенографии, компьютерной томографии и ультразвукового исследования [21]. Термин "псевдоподагра" впервые использовал N. Kohn в 1962 году для описания острых эпизодов синовита, вызванного кристаллами пирофосфата кальция [22]. Соответственно, псевдоподагра представляет собой кристаллический артрит и может быть одним из вариантов течения болезни отложения кристаллов пирофосфата кальция. Острая пирофосфатная артропатия проявляется эпизодами моноили олигоартрита (хотя возможно развитие и полиартрита), чаще поражающего коленные, лучезапяcтные и пястнофаланговые суставы и обычно сопровождающегося лихорадкой, лейкоцитозом и повышением содержания острофазных белков в крови. В отличие от подагры, первый плюснефаланговый сустав вовлекается реже, боль нарастает более постепенно и может сохраняться в течение длительного времени несмотря на лечение [23]. У части пациентов отложение кристаллов пирофосфата кальция сопровождается развитием хронического кристаллического артрита. Возможно и бессимптомное течение пирофосфатной артропатии, которая может сочетаться с остеоартритом [24]. Прояв ления пирофосфатной артропатии могут быть также сходными с таковыми ревматической полимиалгии.
Золотого стандарта диагностики пирофосфатной артропатии не существует [20]. Наличие хондрокальциноза суставов имеет важное диагностическое значение, однако чувствительность рентгенографии относительно невысокая. Для выявления депозитов пирофосфата кальция небольшого размера используют ультразвуковое исследование и компьютерную томографию. Выявление кристаллов пирофосфата кальция в синовиальной жидкости подтверждает диагноз, однако исследование должно проводиться опытным специалистом, учитывая возможность ложноотрицательного результата.
Вероятность развития пирофосфатной артропатии увеличивается с возрастом, особенно после 50 лет. Кроме того, она может сочетаться не только с ГФФ, но и некоторыми другими метаболическими заболева ниями, такими как первичный и вторичный гипер паратиреоз, наследственный гемохроматоз или гипомагнезиемия. Исключать эти заболевания необходимо в первую очередь в тех случаях, когда пирофосфатная артропатия развивается в более молодом возрасте (<55 лет) [20].
Моисеев А.С. Одно из типичных проявлений ГФФ – выпадение зубов, которое при отсутствии других проявлений рассматривают как отдельную форму заболевания, хотя одонтогипофосфатазия может предшествовать появлению других симптомов в старшем возрасте, что иллюстрирует следующее наблюдение.
Пациент С., 52 лет. В возрасте 20 лет выпали практически все зубы (за исключением двух передних). На протяжении многих лет беспокоят боли в нижних конечностях и поясничной области. В возрасте 46 лет диагностирован остеопороз поясничного отдела позвоночника и бедренных костей. Консультирован в Национальном медицинском исследовательском центре травматологи и ортопедии им. Н.Н. Приорова. При обследовании обращало на себя внимание снижение активности ЩФ до 29-33 ед/л. Заподозрен диагноз ГФФ. При молекулярно-генетическом исследовании выявлена мутация гена ALPL c.119C>T, описанная как патогенная, в гетерозиготном состоянии. При обследовании в клинике им. Е.М. Тареева летом 2023 года активность ЩФ составляла 34 ед/л. При денситометрии прогрессирования остеопороза не отмечено. При рентгенографии определялись недостаток оссификации эпифизов большеберцовой и малоберцовой костей, участки разрешения в эпифизах и метафизах костей кистей. Подтвержден диагноз ГФФ. Рекомендована ферментозаместительная терапия асфотазой альфа
В представленном наблюдении проявления ГФФ включали в себя практически полное выпадение зубов в молодом возрасте, значительное снижение минеральной плотности костей, боли в мышцах и стойкое снижение активности ЩФ. Диагноз ГФФ подтверждался наличием семейного анамнеза (два перелома у 16-летнего сына) и мутации гена ALPL, выявленной как у самого пациента, так и его сына. Выпадение постоянных зубов нередко отмечается у взрослых. Например, по данным опроса более 470 000 взрослых американцев (средний возраст 55 лет, 60% женщин), выпадение 6 и более зубов наблюдалось у 10% респондентов, всех зубов – у 5% [25]. Возможными факторами риска выпадения зубов считают сахарный диабет и другие хронические заболевания. Тем не менее, при выпадении зубов в молодом возрасте необходимо обсуждать возможность наличия наследственных заболеваний, прежде всего ГФФ.
Моисеев С.В. Возможно ли поражение почек при ГФФ?
Чеботарева Н.В. У взрослых пациентов с ГФФ содержание кальция, витамина D и партагормона в крови обычно нормальное. Тем не менее, остеомаляция при этом заболевании иногда сопровождается гиперкальциемией и гиперкальциурией и может привести к развитию нефрокальциноза и нефролитиаза. Соли кальция в большинстве случаев откладываются в мозговом веществе почек и значительно реже в корковом слое [26]. Нефрокальциноз может быть выявлен при обычной рентгенографии, ультразвуковом исследовании или компьютерной томографии. При ГФФ у взрослых он не имеет существенного клинического значения.
Моисеев С.В. Как подтвердить диагноз ГФФ? Какое значение имеются результаты рентгенографии костей и денситометрии? Как интерпретировать результаты молекулярно-генетического исследования?
Моисеев А.С. В случае развития ГФФ в старшем возрасте рахитоподобная деформация конечностей или изменения формы грудной клетки обычно отсутствуют. Так, среди 141 пациента со взрослой формой ГФФ, включенных в Международный регистр, частота деформации костей составила всего 6,4%, в то время как у взрослых пациентов с детской формой заболевания она достигла 17,2% [16]. Характерный рентгенологический признак остеомаляции у детей – "языки пламени", которые соответствуют участкам низкой минерализации костной ткани в метафизах. Как указано выше, у взрослых остеомаляция обычно сопровождается появлением зон Лоозера (псевдопереломов), которые считают ключевым признаком снижения минерализации и нарушения ремоделирования костной ткани [27]. При ГФФ они чаще всего локализуются в костях нижних конечностях, прежде всего бедренной и плюсневых. Надежным методом диагностики остеопороза является денситометрия, однако результаты этого исследования у пациентов с ГФФ оказались неоднозначными. В наиболее крупном исследовании у 110 взрослых пациентов с ГФФ (84 женщины, средний возраст 46,2 года) минеральная плотность костей (МПК), которую измеряли с помощью рентгеновской денситометрии, в целом не была снижена, хотя у по крайней мере один перелом в анамнезе наблюдался у 53 из них (при минимальной или недостаточной травме у 31) [28]. Более того, МПК в области поясничного отдела позвоночника увеличивалась с возрастом и была выше у пациентов с более тяжелой ГФФ. Хотя большинство переломов, связанных с ГФФ, отмечались в нижних конечностях (бедренная, большеберцовая и плюсневые кости), МПК в области бедра была снижена умеренно (остеопения) и не позволяла предсказать возникновение переломов. Мы также не выявили существенного снижения МПК у 54-летней женщины с повторными переломами в анамнезе. По мнению F. Genest и соавт., увеличение МПК в области поясничного отдела позвоночника у пациентов с ГФФ может отражать компенсаторное аппозиционное костеообразование (напоминающие диффузный идиопатический гиперостоз скелета и кальцификацию окружающей мягкотканных структур и связок), а также повышенное содержание остеоида в сочетании с неадекватной минерализацией костей [28].
Моисеев С.В. Для лечения остеопороза широко применяют бисфосфонаты, однако эти препараты противопоказаны при ГФФ, так как они являются аналогами неорганического пирофосфата и, соответственно, могут способствовать ухудшению минерализации костной ткани и возникновению переломов [29]. Единственным методом патогенетического лечения ГФФ является ферментозаместительная терапия асфотазой альфа, которая представляет собой человеческий рекомбинантный тканенеспецифический химерный Fc-декааспартатный гликопротеин ЩФ. Препарат применяют подкожно в дозе 2 мг/кг три раза в неделю или в дозе 1 мг/кг шесть дней в неделю (максимальная доза – 6 мг/кг/нед).
Первоначально эффективность асфотазы альфа была установлена в исследованиях у детей с ГФФ, у которых ферментозаместительная терапия вызывала значительное улучшение минерализации костной ткани, мышечной силы, дыхательной функции, двигательной активности [30]. При угрожающих жизни перинатальной и инфантильной формах ГФФ применение асфотазы альфа (n=37) по сравнению с "историческим контролем" (n=48) привело к значительному увеличению выживаемости с 42% до 95% в возрасте 1 года и с 27% до 84% в возрасте 5 лет [31]. Среди детей, нуждавшихся в вентиляции легких, в результате ферментозаместительной терапии выживаемость также увеличилась с 5% до 76%, причем большинство детей, получавших асфотазу альфа, удалось отлучить от вентилятора.
Каковы результаты ферментозаместительной терапии асфотазой альфа у взрослых пациентов?
Моисеев А.С. Изучение эффективности новых препаратов при орфанных заболеваниях представляет трудную задачу. Ограниченное число пациентов с ГФФ уменьшает статистическую силу исследований и препятствует изучению клинических конечных точек, таких как переломы, особенно при относительно медленном прогрессировании патологического процесса или поздней диагностике заболевания, когда некоторые его проявления могут оказаться необратимыми. Эффективность длительной ферментозаместительной терапии асфотазой альфа у взрослых пациентов с ГФФ изучалась в открытом наблюдательном исследовании EmPATHY, которое проводилось в Германии [32]. В него были включены 22 пациента (17 женщин и 5 мужчин) в возрасте в среднем 48,7 лет с ГФФ, развившейся в возрасте до 18 лет. У 19 пациентов были выявлены компаунд-гетерозиготные варианты гена ALPL, у 1 – гомозиготный, у 2 – гетерозиготные. Проявления ГФФ включали в себя повторные переломы, мышечную слабость, которая ограничивала повседневную активность, боль и изменения зубов. Для оценки функциональной активности использовали пробу с 6-минутной ходьбой, тест "Встань и иди" (Timed Up-and-Go) и Краткую батарею тестов физической активности (The Short Physical Performance Battery, SPPB). Последняя включает в себя оценку равновесия, скорость ходьбы на расстоянии 4 метра и пятикратный подъем со стула без помощи рук. Кроме того, измеряли силу мышц с помощью ручного динамометра и определяли показатели качества жизни по шкале SF-36.
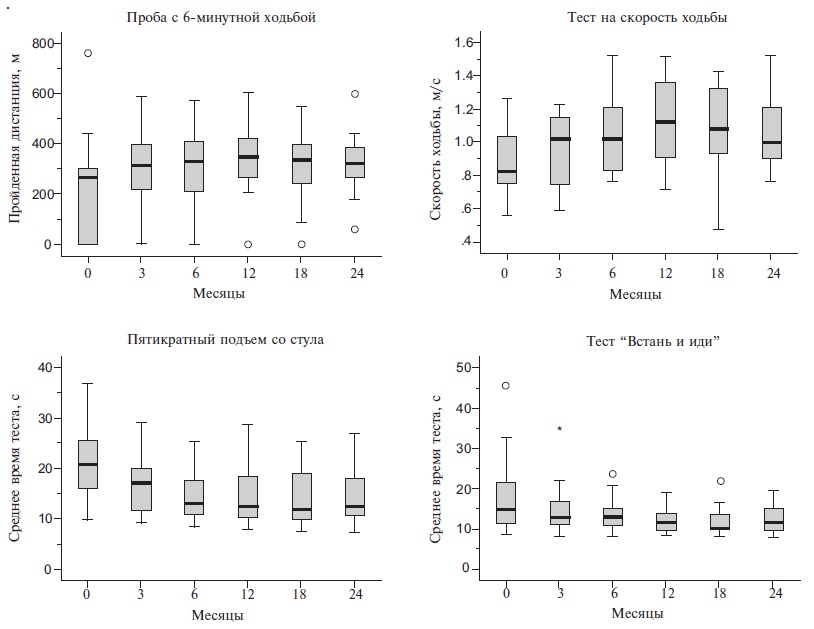
Показатели физической функции значительно улучшились уже через 3 мес после начала лечения асфотазой альфа, а достигнутый эффект сохранялся в течение 2 лет (рис. 2). Медиана пройденной за 6 минут дистанции достоверно увеличилась с 266 до 347 м через 12 мес (р=0,034), после чего этого показатель оставался стабильным. Эти изменения сопровождались достоверным улучшением показателей качества жизни (физический и психический компоненты опросника SF-36). В то же время интенсивность боли существенно не изменилась. Ферментозаместительная терапия вызывала также увеличение маркеров костного обмена, в частности остеокальцина, N-пропептида проколлагена 1 типа (P1NP), тартратрезистентной кислой фосфазаты 5b (TRAP5b) и N-терминального телопептида коллагена 1 типа (NTx), что указывало на начало ремоделирования костной ткани. Последнее подтверждалось преходящим увеличением содержания паратгормона, которое могло отражать повышенную потребность в кальции для восстановления дефектов минерализации костей. Таким образом, в этом исследовании у пациентов с тяжелой детской формой ГФФ асфотаза альфа вызывала быстрое улучшение показателей функциональной активности и качества жизни, которое сохранялось при продолжении терапии в течение 2 лет.
В международном рандомизированном исследовании эффективность и безопасность асфотазы альфа изучали у 19 подростков и взрослых пациентов (в возрасте от 13 до 66 лет) с ГФФ [33]. Во время первой 6-месячной фазы исследовании сравнивали две дозы препарата (0,3 и 0,5 мг/кг) с отсутствием лечения, после чего все пациенты продолжали ферментозаместительную терапию в течение 4,5 лет (после первого года в дозе 1 мг/кг). Первичным показателем эффективности были изменения концентраций неорганического фосфата и пиридоксаль 5’-фосфата, которые достоверно снизились во время 5-летнего исследования (р<0,05). Значения МПК у обследованных пациентов соответствовали возрасту и оставались стабильными. Медиана пройденной за 6 минут дистанции через 5 лет значительно увеличилась с 355 до 450 м (р<0,05). Кроме того, наблюдалось улучшение двигательной функции, силы мышц и функциональной активности пациентов. Переносимость препарата была в целом хорошей.
Таким образом, в опубликованных исследованиях длительная ферментозаместительная терапия асфотазой альфа у взрослых пациентов с детской формой ГФФ вызывала нормализацию содержания метаболитов (неорганического фосфата и пиридоксаль 5’-фосфата), которые накапливаются при дефиците ЩФ, и вызывала стойкое улучшение показателей функциональной активности и качества жизни.
Моисеев С.В. ГФФ – это редкое наследственное заболевание, характеризующееся нарушением минерализации костной ткани (остеомаляцией) вследствие дефицита ЩФ. В клинической картине ГФФ преобладают скелетномышечные проявления (повторные переломы, боли в костях и мышцах, снижение мышечной силы, раннее выпадение зубов), которые могут появиться как в детском, так и старшем возрасте. Лабораторным признаком ГФФ является стойкое снижение активности ЩФ, которое позволяет заподозрить этот диагноз при наличии соответствующих клинических симптомов. Для подтверждения диагноза ГФФ проводят секвенирование гена ALPL, кодирующего неспефическую ЩФ. Cледует учитывать, что клинические проявления ГФФ могут наблюдаться при наличии как гомозиготных и компаунд-гетерозиготных, так и гетерозиготных вариантов гена ALPL.
О симптомах ГФФ должны быть в первую очередь осведомлены не только педиатры, но и ревматологи, эндокринологи, травматологи/ортопеды и стоматологи, к которым обращаются взрослые пациенты с этим заболеванием. В отличие от остеопороза, остеомаляция при ГФФ может не сопровождаться снижением МПК. Более того, риск переломов ассоциировался с увеличением МПК в области поясничного отдела позвоночника.
Важность своевременной диагностики ГФФ определяется возможностью ферментозаместительной терапии рекомбинантным аналогом ЩФ – асфотазой альфа. Бисфосфонаты не следует применять для лечения ГФФ, так как они снижают активность ЩФ и могут способствовать ухудшению минерализации костной ткани и увеличению риска переломов.
Используемые источники
- Родионова С.С., Захарова Е.Ю., Буклемишев Ю.В. и др. Гипофосфатазия у взрослых: клинические случаи и обзор литературы. Остеопороз и остеопатии 2015;18(2):25-8 [Rodionova SS, Zakharova EYu, Buklemishev YuV, et al. Hypophosphatasia in adults: clinical case and literature review. Osteoporosis and Bone Diseases 2015;18(2):25-8. (In Russ.)].
- Rathbun JC. Hypophosphatasia: a new developmental anomaly. Am J Dis Child 1948;75:822-31.
- Reis FS, Lazaretti-Castro M. Hypophosphatasia: from birth to adulthood. Arch Endocrinol Metab 2023;67(5):e000626.
- Mornet E. Genetics of hypophosphatasia. Arch Pediatr 2017;24(5S2):5S51-6.
- Нарушение обмена фосфора (гипофосфатазия). Клинические рекомендации, 2023 г.
- Unger S, Ferreira CR, Mortier GR, et al. Nosology of genetic skeletal disorders: 2023 revision. Am J Med Genet 2023;191(5):1164-209. .
- Greenberg CR, Taylor CL, Haworth JC, et al. A homoallelic Gly317Asp mutation in ALPL causes the perinatal (lethal) form of hypophosphatasia in Canadian Mennonites. Genomics 1993;17:215-7.
- Mornet E, Yvard A, Taillandier A, et al. A molecular-based estimation of the prevalence of hypophosphatasia in the European population. Ann Hum Genet 2011;75(3):439-45.
- Whyte MP. Hypophosphatasia — aetiology, nosology, pathogenesis, diagnosis and treatment. Nat Rev Endocrinol 2016;12(4):233–46.
- Seefried L, Dahir K, Petryk A, et al. Burden of illness in adults with hypophosphatasia: data from the Global Hypophosphatasia Patient Registry. J Bone Miner Res 2020;35(11):2171-8.
- Schmidt T, Schmidt C, Amling M, et al. Prevalence of low alkaline phosphatase activity in laboratory assessment: Is hypophosphatasia an underdiagnosed disease? Orphanet J Rare Dis 2021;16(1):452.
- McKiernan FE, Dong J, Berg RL, et al. Mutational and biochemical findings in adults with persistent hypophosphatasemia. Osteoporos Int 2017;28(8):2343-8.
- Hepp N, Frederiksen AL, Duno M, et al. Biochemical, clinical and genetic characteristics in adults with persistent hypophosphatasaemia; Data from an endocrinological outpatient clinic in Denmark. Bone Rep 2021;15:101101.
- Feurstein J, Behanova M, Haschka J, et al. Identifying adult hypophosphatasia in the rheumatology unit. Orphanet J Rare Dis 2022;17(1):435.
- García-Fontana C, Villa-Suárez JM, Andújar-Vera F, et al. Epidemiological, clinical and genetic study of hypophosphatasia in a Spanish population: identification of two novel mutations in the ALPL gene. Sci Rep 2019;9(1):9569.
- Dahir KM, Seefried L, Kishnani PS, et al. Clinical profiles of treated and untreated adults with hypophosphatasia in the Global HPP Registry. Orphanet J Rare Dis 2022;17(1):277.
- Dahir KM, Kishnani PS, Martos-Moreno G, et al. Impact of muscular symptoms and/or pain on disease characteristics, disability, and quality of life in adult patients with hypophosphatasia: A cross-sectional analysis from the Global HPP Registry. Front Endocrinol (Lausanne) 2023;14:1138599.
- Fayaz A, Croft P, Langford RM, et al. Prevalence of chronic pain in the UK: a systematic review and meta-analysis of population studies. BMJ Open 2016;6(6):e010364.
- Richette P, Bardin T, Doherty M. An update on the epidemiology of calcium pyrophosphate dihydrate crystal deposition disease. Rheumatology (Oxford) 2009;48(7):711-5.
- Zhang W, Doherty M, Bardin T, et al. European League Against Rheumatism recommendations for calcium pyrophosphate deposition. Part I: terminology and diagnosis. Ann Rheum Dis 2011;70(4):563–70.
- Abhishek A, Tedeschi SK, Pascart T, et al. The 2023 ACR/EULAR classification criteria for calcium pyrophosphate deposition disease. Arthritis Rheumatol 2023 Jul 26. doi: 10.1002/art.42619.
- Kohn N. The significance of calcium pyrophosphate crystals in the synovial fluid of arthritic patients: the ‘pseudogout syndrome’. II Identification of crystals. Ann Intern Med 1962;56(56):738–45.
- Masuda I, Ishikawa K. Clinical features of pseudogout attack. A survey of 50 cases. Clin Orthop Relat Res 1988;229:173–81.
- Cowley S, McCarthy G. Diagnosis and treatment of calcium pyrophosphate deposition (CPPD) disease: A review. Open Access Rheumatol 2023;15:33-41.
- Zhang Y, Leveille SG, Shi L. Multiple сhronic diseases associated with tooth loss among the US adult population. Front Big Data 2022;5:932618.
- Shavit L, Jaeger P, Unwin RJ. What is nephrocalcinosis? Kidney Int 2015;88(1): 35-43.
- Голоунина О.О., Рунова Г.Е., Фадеев В.В. Остеомаляция в практике эндокринолога: этиология, патогенез, дифференциальная диагностика с остеопорозом. Остеопороз и остеопатии 2019;22(2):23-31 [Golounina OO, Runova GE, Fadeyev VV. Osteomalacia in practice of endocrinologist: etiology, pathogenesis, differential diagnosis with osteoporosis. Osteoporosis and Bone Diseases 2019;22(2):23-31 (In Russ.)].
- Genest F, Clauen L, Rak D, Seefried L. Bone mineral density and fracture risk in adult patients with hypophosphatasia. Osteoporos Int 2021;32(2):377-85.
- Sutton RA, Mumm S, Coburn SP, et al. “Atypical femoral fractures” during bisphosphonate exposure in adult hypophosphatasia. J Bone Mineral Res 2012;27(5):987–94.
- Scott LJ. Asfotase alfa: A review in paediatric-onset hypophosphatasia. Drugs 2016;76(2):255-62.
- Whyte MP, Rockman-Greenberg C, et al. Asfotase alfa treatment improves survival for perinatal and infantile hypophosphatasia. J Clin Endocrinol Metab 2016;101(1):334-42.
- Seefried L, Genest F, Petryk A, Veith M. Effects of asfotase alfa in adults with pediatric-onset hypophosphatasia over 24 months of treatment. Bone 2023;175: 116856.
- Kishnani PS, Rockman-Greenberg C, Rauch F, et al. Five-year efficacy and safety of asfotase alfa therapy for adults and adolescents with hypophosphatasia. Bone 2019;121:149-62.
