Периодический синдром, ассоциированный с мутацией рецептора фактора некроза опухоли (TRAPS)
Периодический синдром, ассоциированный с мутацией рецептора фактора некроза опухоли (TRAPS), наряду с периодической болезнью, относится к группе семейных периодических лихорадок – редких наследственных аутовоспалительных заболеваний. Характеризуется приступами лихорадки, которые возникают без явной причины, сопровождаются болями в животе, макулопапулезной сыпью, болями в мышцах и суставах и лабораторными признаками воспаления и продолжаются от 5 дней до 3 недель. Персистирование аутовоспаления при TRAPS может привести к развитию АА-амилоидоза. В статье на примере двух наблюдений обсуждаются сложности диагностики и методы лечения TRAPS.
С.В. Моисеев. Периодический синдром, ассоциированный с мутацией рецептора фактора некроза опухоли (tumor necrosis factor receptor-associated periodic syndrome – TRAPS) – это редкое моногенное аутовоспалительное заболевание, которое передается по аутосомно-доминантному типу. TRAPS был впервые описан в 1982 г. у 16 членов большой ирландской семьи в трех поколениях [1]. Все они жаловались на приступы лихорадки, сопровождавшейся миалгиями и кожными высыпаниями, а также болями в животе, лейкоцитозом и повышением СОЭ. Позднее М. McDermott и соавт. установили, что причиной TRAPS являются мутации гена TNFRSF1A, кодирующего рецептор фактора некроза опухоли (ФНО) 1 типа, и впервые предложили концепцию аутовоспаления как основы патогенеза ряда наследственных заболеваний, сопровождающихся генетически обусловленным нарушением врожденного иммунитета [2].
Особенностью аутовоспалительных заболеваний является развитие локализованного или системного воспаления при отсутствии аутоиммунных нарушений, связанных с продукцией аутоантител В-лимфоцитами или агрессией аутореактивными Т-лимфоцитами. При этом воспаление обеспечивается исключительно силами фагоцитов системы врожденного иммунитета [3]. Первоначально к этой группе относили несколько редких моногенных заболеваний, таких как периодическая болезнь (семейная средиземноморская лихорадка), криопирин-ассоциированный синдром и др., однако постепенно количество известных наследственных аутовоспалительных заболеваний увеличивалось и сегодня исчисляется несколькими десятками. При некоторых аутовоспалительных заболеваниях, в частности болезни Стилла взрослых или идиопатическом рецидивирующем перикардите, первичный генетический дефект не установлен, в связи с чем их развитие связывают с множественной экспрессией провоспалительных генов. Ауто воспаление имеет важное значение и в патогенезе более распространенных воспалительных заболеваний, в том числе пода грического артрита, спондилоартрита, воспалительных заболеваний кишечника и др. Более того, оно вносит определенный вклад и в развитие "классических" аутоиммунных заболеваний, таких как системная красная волчанка или АНЦА-ассоциированные васкулиты. Соответствен но, иммуновоспалительные заболевания можно рассматривать как континуум, предполагающий взаимодействие врожденного и приобретенного (адаптивного) иммунитета и преобладание тех или иных нарушений [4,5]. Каковы механизмы развития TRAPS и его основные клинические проявления?
В.В. Рамеев. TRAPS – это системное аутовоспалительное заболевание, которое наследуется по аутосомно-доминантному типу и обусловлено мутациями в гене TNFRSF1A, кодирующем p55 субъединицу рецептора ФНО-α [6]. В настоящее время известно более 170 миссенс мутаций этого гена, которые затрагивают главным образом 3 и 4 экзоны [7]
Известно, что рецепция клеткой сигнала от ФНО-α воспринимается через два типа рецепторов. Рецепторы 1-го типа содержат так называемый "домен смерти", через который по сигнальной системе TRADD/FADD происходит индукция активности каспаз 8-го типа, синтез церамида, что завершается апоптозом клетки. На модели культуры опухолевых клеток этот эффект сопровождался их гибелью, что и дало повод называть цитокин фактором некроза. Рецепторы 2-го типа, в целом, противодействуют эффектам от рецепторов 1-го типа через собственную сигнальную систему, опосредуемую белком RIP-1 и вызывающую активацию экспрессии антиапоптотического белка-1. Существует также третья сигнальная система TRAF-2/5, которую запускают оба типа рецепторов. Эта сигнальная система при посредстве NF-kB позволяет ФНО-α реализовывать свои функции как продукту гена главного комплекса совместимости III класса по обеспечению процессинга антигенов. Таким образом, сложные механизмы воздействия ФНО-α на клетку отражают его длительную эволюцию как участника системы главного комплекса гистосовместимости к функционированию в качестве провоспалительного цитокина и объясняют нередко противоречивые биологические эффекты этого цитокина.
При TRAPS мутация поражает рецепторы 1-типа, что и находит отражение в обозначении гена этого рецептора цифрой 1 – TNFRSF1A. Мутация рецептора приводит к нарушению шеддинга (смывания) комплекса рецептор- ФНО-α с поверхности клетки. При этом комплекс становится фактором гиперстимуляции клетки. Такой мощный проапоптотический эффект, вероятно, является одним из факторов внутриклеточного стресса, характерного для TRAPS. С другой стороны, накопленные мембраной клеток несмываемые комплексы рецептор-цитокин воспринимаются клеткой как аномальные белки, подлежащие элиминации, что приводит к активации системы внутриклеточной деградации белков, а комплекс рецептор-цитокин подвергается эндоцитозу и разрушению в фаголизосомах. Этот процесс обозначается термином аутофагия, требует значительных затрат энергии и в условиях массового эндоцитоза аномальных белковых комплексов становится решающим фактором внутриклеточного стресса, результатом которого является мощная гиперпродукция интерлейкина (ИЛ)-1 [8]. Именно этому механизму придают ведущее значение в реализации воспаления при TRAPS [6,8].Р
Попутно заметим, что дисфункция системы аутофагии является ведущим локальным механизмом амилои догенеза в тканях, а постоянное раздражение системыаутофагии становится одной из причин высокой часто ты амилоидоза при аутовоспалительных заболеваниях.
Л.В. Лысенко (Козловская). Основное проявление TRAPS – приступы лихорадки, которые возникают без явной причины или под действием факторов окружающей среды (эмоциоциональное напряжение, физические нагрузки, инфекции, травма и т.п.) и сопровождаются болями в животе, макулопапулезной сыпью, болями в мышцах и суставах и другими симптомами. Обычно эпизоды лихорадки развиваются каждые 4-6 недель и продолжаются от 5 дней до 3 недель [7]. Сходные проявления отмечаются и при ряде других системных аутовоспалительных заболеваний, которые в зарубежной литературе называют "семейными периодическими лихорадками". Наряду с TRAPS, они включают в себя периодическую болезнь (семейную средиземноморскую лихорадку), криопирин-ассоциированный периодический синдром (CAPS) и синдром недостаточности мевалонаткиназы/гипериммуноглобулинемии D (HIDS/MKD). Клиническую картину TRAPS и трудности распознавания заболевания иллюстрирует следующее наблюдение.
М.В. Барсук. Пациент П. в возрасте 24 лет перенес острый моноартрит большого пальца правой стопы. Учитывая повышение уровня мочевой кислоты до 500600 мкмоль/л, диагностирована подагра, которая периодически рецидивировала. Через 5 лет сформировались периартикулярные тофусы. Пациент связывал атаки подагры с эпизодами употребления алкоголя и в дальнейшем практически отказался от его употребления. Подагра более не рецидивировала, однако сохранялась гиперурикемия, беспокоили артралгии, отмечалась почечная колика с отхождением гладких светлых конкрементов.
В возрасте 30 лет впервые развился приступ болей в животе, сопровождавшийся лихорадкой до 39оС, тошнотой и изжогой и продолжавшийся 3 дня. На протяжении последующих 40 лет приступы болей повторялись один раз в 1-2 года. Иногда они сопровождались симптомами раздражения брюшины, что давало основание обсуждать диагноз аппендицита, однако врачи всякий раз удерживались от оперативного вмешательства. Пациент привык к этим болям и старался не обращаться к врачам по их поводу, чтобы избежать ненужного хирургического вмешательства. При обследовании отмечалось стойкое повышение содержания С-реактивного белка (СРБ) до 45 мг/л.
У дочери с 29 лет также эпизоды лихорадки, артралгий и миалгий длительностью от 4 до 30 дней, которые развивались с интервалами от 2 недель до нескольких лет. Во время приступа уровень СРБ повышался до 5080 мг/л, но вне приступа оставался нормальным. В возрасте 37 лет обследована в НИИ ревматологии им. В.А. Насо но вой. Ревматоидный фактор, антинуклеарный фактор и антитела к цитоплазме нейтрофилов не обнаружены. Учитывая наличие приступов у отца, обсуждался диагноз семейной периодической лихорадки. При молекулярно-генетическом исследовании мутации генов периодической болезни (MEFV), криопирина (NLRP3) и мевалонаткиназы (MVK) не выявлены, но обнаружена мутация гена рецептора ФНО-α (TNFSFR1A Arg121Trp). Установлен диагноз TRAPS.
С.О. Салугина. С. Cudrici и соавт. обобщили клинические проявления TRAPS у 209 пациентов, которые были включены в ранее опубликованные исследования (рис. 1) [6]. Ведущим симптомом заболевания были приступы лихорадки, которая наблюдалась практически у всех пациентов (96%) и обычно сопровождалась болями в животе (70%), артралгиями/миалгиями (69%) и эритематозными высыпаниями (60%). Реже встречались боль в груди (33%), острый конъюнктивит (37%), периорбитальный отек (28%), артрит (22%), лимфаденопатия (16%), увеличение печени и/или селезенки (4%) и головная боль (13%). Причиной болей в животе и грудной клетки при TRAPS является воспаление серозных оболочек, вызывающее рецидивирующие эпизоды асептического перитонита, перикардита и плеврита. Во время приступа всегда определяются лабораторные признаки воспаления, такие как увеличение содержания СРБ и СОЭ, тромбоцитоз и нейтрофильный лейкоцитоз. Между приступами содержание СРБ и СОЭ чаще нормализуются, но могут оставаться повышенными.
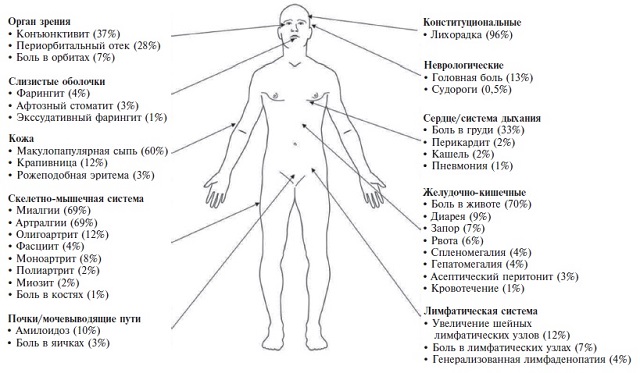
Приступы обычно начинаются в детском возрасте, хотя могут появиться в старшем или даже пожилом возрасте. По данным международного регистра Eurofever/ EUROTRAPS, в который включено 158 пациентов с TRAPS, у 22% пациентов начало заболевания было зарегистрировано в возрасте старше 18 лет, а у 9% – старше 30 лет (максимум в 63 года) [7]. Необходимо также учитывать, что диагноз редких системных аутовоспалительных заболеваний, как и в наших двух наблюдениях, часто устанавливают с большим опозданием, иногда спустя десятилетия после появления первых симптомов. Например, среди 1049 пациентов с различными моногенными аутовоспалительными заболеваниями, включенных в международный регистр Eurofever, медиана срока от начала болезни до установления диагноза составила 7,3 года (от 0,3 до 76 лет) [9], а при TRAPS – 10,3 года (от 0 до 77 лет) [7]. Как указано выше, для установления диагноза у нашего пациента потребовалось 40 лет, причем мутации гена TNFSFR1A была выявлена при семейном скрининге.
С.В. Моисеев. Сходные клинические проявления (лихорадка, артралгии/артрит, миалгии, кожные высыпания и т.п.) наблюдаются при системных аутоиммунных заболеваниях, таких как системная красная волчанка. Что необходимо учитывать при дифференциальной диагностике?
Н.В. Чеботарева. У взрослых пациентов при наличии длительного анамнеза (месяцы или годы) дифференциальная диагностика семейных периодических лихорадок и аутоиммунных заболеваний обычно не представляет больших трудностей. При опросе прежде всего обращает на себя внимание стереотипность приступов TRAPS, их преходящий характер и отсутствие каких-либо симптомов в межприступные интервалы. Хотя изменения лабораторных показателей сходны с таковыми при аутоиммунных заболеваниях, специфические лабораторные нарушения (антинуклеарный фактор, антитела к ДНК, ревматоидный фактор и т.п.) при TRAPS, как и других семейных периодических лихорадках, обычно не определяются. Однако длительно нелеченный TRAPS вследствие персистирования аутовоспаления может вторично активировать и систему специфического иммунитета. Так, длительная гиперпродукция интерлейкина-6 является мощным стимулятором В-лимфоцитов, в этом случае возможно обнаружение аутоантител в умеренно повышенных титрах.
Следует отметить, что примерно у 60% больных с TRAPS приступы возникают нерегулярно. Среди пациентов, включенных в регистр Eurofever/EUROTRAPS, регулярные приступы отмечались только в 12% случаев, хотя у детей они наблюдались чаще, чем у взрослых (26% и 5%, соответственно; p<0,05) [7]. У 25% пациентов приступы развивались под действием различных триггеров, таких как эмоциональное напряжение, менструации, инфекции, физические нагрузки и вакцинация. В пользу наследственного генеза заболевания могут свидетельствовать начало приступов в детском возрасте и положительный семейный анамнез (примерно в 80% и 40% случаев, соответственно). При анализе последнего следует учитывать возможную вариабельность фенотипов заболевания у родственников пробанда. В наших наблюдениях именно наличие похожих приступов у отца и его дочери позволило заподозрить наследственное заболевание и послужило основанием для молекулярно-генетического исследования.
Сложнее установить диагноз в начале заболевания, когда короткий анамнез не дает возможности оценить стереотипное течение TRAPS, особенно при наличии более длительных интервалов между приступами. В заблуждение может ввести и ложноположительный эффект эмпирической терапии антибиотиками или глюкокортикостероидами, которую нередко назначают при наличии лихорадки и лабораторных признаков воспаления. Если лихорадка сочетается с болями в животе, признаками перитонита и нейтрофильным лейкоцитозом, приходится исключать острые хирургические заболевания, прежде всего аппендицит. Таким пациентам нередко проводят оперативные вмешательства, иногда повторные. При непрододолжительных приступах исклю чить хирургическое заболевание позволяет бы строе улучшение состояния пациента без какого-либо лечения.
С.В. Моисеев. Приступы болей в животе характерны для периодической болезни. Как отличить TRAPS от этого заболевания и других семейных периодических лихорадок? Существуют ли классификационные критерии этих заболеваний? Какова роль молекулярно-генетического исследования в диагностике TRAPS?
Л.В. Лысенко (Козловская). Приступы абдоминалгий и торакалгий, обусловленные асептическим воспалением серозных оболочек, наблюдаются как при TRAPS, так и периодической болезни. Боли в животе, сопровождающиеся рвотой и диареей, а также шейным лимфаденитом, часто встречаются и у пациентов с MKD/HIDS – аутосомно-рецессивным заболеванием, связанным с мутациями гена MVK, которые приводят к дефициту мевалонаткиназы и дисфункции гуанозинтрифосфатазы, активирующей пириновую инфламмасому. При периодической болезни приступы болей в животе обычно короткие и продолжаются несколько дней, в то время как для TRAPS характерны более длительные приступы. По данным регистра Eurofever/ EUROTRAPS, у 68% пациентов с TRAPS приступы продолжались более 7 дней, в том числе у 14% – более 14 дней [7]. Однако длительность приступов не позволяет надежно дифференцировать два заболевания, так как при периодической болезни приступы могут затягиваться, а у трети пациентов с TRAPS они продолжаются менее 7 дней. У обследованного нами пациента приступы бол в животе были короткими и обычно продолжались не более 3 дней. Для диагностики периодической болезни важное значение имеет этническая принадлежность пациента. В России это заболевание чаще встречается у армян, реже – у представителей некоторых других национальностей (азербайджанцев, греков, евреев и др.), однако этнический критерий также бывает ненадежным [10].
Недавно были предложены классификационные критерии, которые могут быть использованы для дифференциальной диагностики моногенных системных аутовоспалительных заболеваний, если приступы лихорадки в сочетании с повышением содержания белков острой фазы (СОЭ, СРБ и/или SAA) продолжаются в течение по крайней мере 6 мес и исключены другие причины воспаления [13]. Эти критерии могут применяться как при наличии, так и отсутствии результатов молекулярно-генетического исследования.
Если у пациента выявлена мутация гена TNFRSF1A, то диагноз TRAPS может быть установлен при наличии по крайней мере одного из перечисленных ниже признаков (или двух при наличии мутации неопределенного клинического значения):- Длительность приступов ≥7 дней
- Миалгии
- Мигрирующая сыпь
- Периорбитальный отек
- Семейный анамнез
-
Наличие:
Лихорадка ≥7 дней (2 балла)
Лихорадка 5-6 дней (1 балл)
Мигрирующая сыпь (1 балл)
Периорбитальный отек (1 балл)
Миалгии (1 балл)
Семейный анамнез (1 балл) -
Отсутствие:
Афтозный стоматит (1 балл)
Тонзиллофарингит (1 балл)
В целом, эти клинические критерии характеризуются меньшей надежностью, чем клинические критерии периодической болезни и, скорее, могут быть основанием для проведения дифференциального диагноза по результатам полноэкзомного секвенирования.
С.В. Моисеев. Чем угрожает TRAPS? Каковы возможные осложнения этого заболевания?
В.В. Рамеев. Основное осложнение TRAPS, как и любого другого моногогенного аутовоспалительного заболевания, – AA-амилоидоз [14]. Среди 158 пациентов с TRAPS, включенных в международный регистр Eurofever/EUROTRAPS, развитие этого осложнения наблюдали в 16 (10%) случаях (медиана возраста 43 года, диапазон от 20 до 77 лет) [7]. У пациентов с AAамилоидозом длительность основного заболевания была ожидаемо больше, чем у пациентов, у которых признаки амилоидоза отсутствовали (39 и 19 лет, соответственно; p<0,001), причем в 13 из 16 случаев первые симптомы появились в детском возрасте. Развитие ААамилоидоза при TRAPS иллюстрирует следующее наблюдение.
А.В. Новиков. Пациентка К. С 21-летнего возраста ежегодно беспокоят приступы лихорадки, сопровождав- шиеся болями и припуханием суставов кистей. При обращении к ревматологу в связи с кратковременным характером артритов, отсутствием деструкции суставов обсуждали диагноз реактивного артрита. Вне приступа отмечалось нормальное содержание СРБ. Ревматоид - ный фактор не определялся. В возрасте 30 лет появи- лись отеки ног, увеличение селезенки, небольшая протеинурия, выраженная анемия (гемоглобин менее 80 г/л), лейкоцитоз и тромбоцитоз. При обследовании у гематолога (стериальная пункция, иммунохимическое исследование, определение филадельфийской хромосо- мы) данных за хроническое миелопролиферативное или другое гематологическое заболевание не выявлено. Отмечено повышение сывороточного уровня креатини- на до 260 мкмоль/л. Развитие анемии связывали с хро- нической почечной недостаточностью. Через год, в возрасте 31 года, после острой респираторной вирусной инфекции отмечено нарастание отеков и увеличение протеинурии до 3,5 г/сут. Содержание креатинина в сыворотке составляло 1300-1500 мкмоль/л, в связи с чем начато лечение гемодиализом, а также эритропоэ- тином и препаратами железа. При биопсии десны и подкожной жировой клетчатки выявлен амилоид. Внепочечных проявлений амилоидоза не обнаружено, в частности толщина задней стенки левого желудочка и межжелудочковой перегородки составляла 10-11 мм, фракция выброса левого желудочка и показатели транс- митрального потока не изменены, амплитуда желудоч- ковых комплексов в стандартных отведениях ЭКГ не снижена.
Для дифференциальной диагностики аутовоспалительного заболевания, осложнившегося вторичным ААамилоидозом, и наследственного транстиретинового амилоидоза проведено молекулярно-генетическое исследование. Обнару жена гетерозиготная мутация гена TNFRSF1A с заменой цистеина на аргинин в 59 положении (Cys59Arg). Мутации генов криопирина, пирина, мевалонаткиназы и транстиретина отсутствовали. Все члены семьи русские, о заболеваниях отца не осведомлена, по материнской линии анамнез не отягощен. Установлен диагноз TRAPS и вторичного АА-амилоидоза. Начато лечение канакинумабом, которое привело к устойчивой нормализации уровней острофазовых маркеров воспаления. Снижение воспалительной активности позволило подготовить пациентку к трансплантации почки, которая была выполнена в возрасте 32 лет. В течение 2 лет трансплантат функционирует удовлетворительно, признаков амилоидоза в трансплантате в виде протеинурии или ухудшения почечной функции нет.
С.В. Моисеев. Как заподозрить АА-амилоидоз при TRAPS и других моногенных аутовоспалительных заболеваниях? Чем он отличается от других вариантов амилоидоза?
Н.М. Буланов. Предшественником АА-амилоидаявляется сывороточный амилоидный А-протеин (SAA)– белок острой фазы, содержание которого в кровиповышается при воспалении, поэтому АА-амилоидозможет развиться при любом хроническом воспалитель ном заболевании, особенно если оно плохо поддаетсялечению. Вероятность развития АА-амилоидоза вышепри длительном сохранении воспаления, в том числесубклинического, признаком которого может служитьстойкое повышение содержания СРБ. Диагноз амилои доза необходимо подтвердить при гистологическомисследовании, причем альтернативой биопсии почкиможет быть исследование слизистой оболочки желудкаили прямой кишки или подкожно-жировой клетчатки,хотя при отрицательном результате биопсии этих тка ней необходимо все же выполнить биопсию почки.Ведущее проявление АА-амилоидоза – поражениепочек, которое проявляется нарастающей протеинуриейпри отсутствии изменений мочевого осадка, в частно сти микрогематурии, и приводит к развитию хрониче ской почечной недостаточности. ОтложенияАА-амилоидоза, как и при других типах системногоамилоидоза, можно обнаружить в разных органах и тка нях, однако клинические проявления их поражениячаще всего отсутствуют. Если у пациента с амилоидо зом определяются признаки поражения сердца (сниже ние амплитуды комплекса QRS на ЭКГ, симметричноеутолщение межжелудочковой перегородки и заднейстенки левого желудочка, дилатация левого предсердияпри отсутствии существенного снижения фракциивыброса левого желудочка, застойная сердечная недо статочность, плохо поддающаяся лечению), необходимов первую очередь исключать AL-амилоидоз, которыйотносят к группе плазмоклеточных дискразий, а такжереже встречающийся ATTR-амилоидоз. В представлен ном наблюдении более вероятным представлялосьналичие АА-амилоидоза, учитывая наличие воспали тельного заболевания, тяжелое поражение почек (неф ротический синдром и хроническая почечнаянедостаточность, потребовавшая заместительной почеч ной терапии), отсутствие признаков поражения сердцаи/или периферической нервной системы, характерныхдля ATTR-амилоидоза. Исключить AL-амилоидоз поз воляло отсутствие моноклональной секреции легкихцепей иммуноглобулинов при иммунохимическомисследовании.
В.В. Рамеев. АА-амилоидоз наблюдается и при дру гих моногенных аутовоспалительных заболеваниях,прежде всего периодической болезни. ПричинамиАА-амилоидоза могут быть также хронические инфек ционные заболевания (туберкулез, остеомиелит,бронхэктазы, аспергиллез, муковисцидоз и др.), имму новоспалительные ревматические болезни (ревматоид ный артрит, псориатический артрит, спондилоартрит,подагра, артериит Такаясу, болезнь Бехчета), злокаче ственные опухоли [15,16]. В последние годы распро страненность АА-амилоидоза и его доля в структуресистемного амилоидоза снизились [17], что отражаетповышение эффективности лечения хронических вос палительных заболеваний, в том числе за счет широко го применения базисных противовоспалительныхпрепаратов и генно-инженерных биологических препа ратов при ревматических болезнях и колхицина припериодической болезни. Например, в исследовании,проводившемся в Турции, у детей с периодическойболезнью было выявлено снижение частоты диагности ки АА-амилоидоза с 12% в 1978-1990 гг. до 2% после2000 г. (p<0,001) [18].
Иногда, как в нашем наблюдении, АА-амилоидоз с поражением почек оказывается первым проявлением, заставляющим обсуждать диагноз аутовоспалительного заболевания [19]. В одном исследовании диагноз АА-амилоидоза предшествовал диагнозу основного заболевания у 40 из 41 пациента с TRAPS [20], что, скорее, свидетельствует о смазанном, преимущественно субклиническом, течении TRAPS, создававшем иллюзию опережающего развития амилоидоза.
С.В. Моисеев. Каковы современные подходы к лечению TRAPS? Можно ли предупредить появление приступов этого заболевания и развитие АА-амилоидоза?
В.В. Рамеев. Для уменьшения признаков воспаления у пациентов с TRAPS, как и другими моногенными аутовоспалительными заболеваниями, нередко применяют глюкокортикостероиды, хотя длительная терапия препаратами этой группы не влияла на частоту приступов заболевания и развитие АА-амилоидоза [6]. Основой лечения периодической болезни является колхицин, однако при TRAPS он значительно менее эффективен [21]. Результаты применения ингибиторов ФНО-α при TRAPS оказались противоречивыми. В сериях наблюдений и неконтролируемых исследованиях этанерцепт вызывал уменьшение частоты приступов заболевания и содержания белков острой фазы у части пациентов с TRAPS [22], однако эффект этого препарата часто оказывается неполным и со временем уменьшается [21]. Другие ингибиторы ФНО-α, в том числе инфликсимаб и адалимумаб, в некоторых случаях вызывали даже парадоксальное увеличение тяжести обострений TRAPS [6].
Хотя механизмы развития TRAPS и других моногенных аутовоспалительных заболеваний отличаются, тем не менее, общим медиатором при аутовоспалительных состояниях является ИЛ-1b, что послужило основанием для изучения блокаторов этого цитокина, в частности канакинумаба – человеческих моноклональных IgG1 антител к ИЛ-1b, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. В отличие от анакинры, канакинумаб оказывает длительное действие, что позволяет вводить его один раз в месяц или даже реже.
Эффективность канакинумаба при семейных периодических лихорадках была установлена в двойном слепом, плацебо-контролируемом исследовании CLUSTER, в которое были включены 46 больных TRAPS, 63 больных колхицинрезистентной периодической болезнью и 72 пациента с MKD/HIDS [23]. У всех пациентов диагноз был подтвержден при молекулярногенетическом исследовании, а течение заболевание было тяжелым. Первичной конечной точкой исследования служила доля пациентов, у которых был достигнут полный ответ через 15 дней (индекс активности <2 и уровень СРБ ≤10 мг/л) и отсутствовали новые обострения в течение 16 недель. Через 15 дней частота купирования обострения TRAPS в группе канакинумаба была достоверно выше, чем в группе плацебо (рис. 2). Еще более выраженное преимущество канакинумаба перед плацебо было выявлено при анализе первичной конечной точки. Частота полного ответа у пациентов c TRAPS составила 45% и 8%, соответственно. При включении в анализ пациентов, у которых дозах канакинумаба была увеличена до 300 мг каждые 4 недели в связи с недостаточной эффективностью лечения, частота полного ответа увеличилась до 73%. Продолжение лечения канакинумабом у больных, достигших полного ответа, позволяло сохранить достигнутый эффект в течение 24 недель у 83% больных TRAPS. Сходные результаты были получены у пациентов с колхицинрезистентной периодической болезнью и MKD/HIDS (рис. 2). Канакинумаб по эффективности превосходил плацебо во всех возрастных группах пациентов, в том числе от 2 до <12 лет, от 12 до <18 лет, 18 лет и старше.
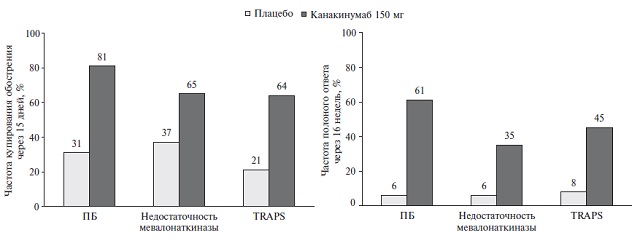
Через 40 недель уровень SAA снизился во всех когортах больных. К этому сроку медиана его концентрации у пациентов с TRAPS составляла 10,5 мг/л, причем в двух третях случаев содержание SAA было ниже 20 мг/л, что ассоциируется с подавлением развития или прогрессирования АА-амилоидоза. Адекватная противовоспалительная терапия обоснована и у пациентов с АА-амилоидозом, уже начавших лечение диализом, для подготовки их к трансплантации почки и профилактики развития амилоидоза в трансплантате.
Результаты исследования CLUSTER позволяют рассматривать канакинумаб как препарат первой линии в лечении TRAPS. В рекомендациях Европейского альянса ассоциаций ревматологов и Американской коллегии ревматологов (EULAR/ACR) указано, что блокаторы ИЛ-1 по эффективности, в том числе частоте достижения ремиссии TRAPS и профилактике отдаленных осложнений, превосходят другие генно-инженерные биологические препараты и стандартные базисные противовоспалительные препараты [24].
С.В. Моисеев. Приведенные наблюдения свидетельствуют о том, что позднее распознавание TRAPS чаще всего определяется не трудностями его диагностики, а низкой информированностью врачей о моногенных системных аутовоспалительных заболеваниях. Пред полагать TRAPS следует при наличии стереотипных приступов лихорадки, которые сопровождаются кожными высыпаниями, миалгиями/артралгиями, болями в животе и/или изменениями со стороны органа зрения, часто начинаются в детском возрасте и обычно продолжаются в течение более 7 дней. Во время приступов, а иногда и в межприступные периоды, определяются лабораторные признаки воспаления (увеличение СОЭ и содержания СРБ, нейтрофильный лейкоцитоз и др.), но отсутствуют в типичном случае специфические аутоантитела, характерные для аутоиммунных заболеваний. Похожие приступы наблюдаются и при других заболеваниях этой группы, в частности периодической болезни, поэтому для дифференциальной диагностики важное значение имеют результаты молекулярно-генетического исследования.
При всех моногенных системных аутовоспалительных заболеваниях возможно развитие АА-амилоидоза почек, который проявляется нарастающей протеинурией и приводит к хронической почечной недостаточности. Как и при других воспалительных заболеваниях в ревматологии хроническое аутовоспаление, в том числе при TRAPS, является фактором риска раннего атеросклероза, что может рассматриваться как еще одно показание для активного лечения субклинически текущего воспаления.
Общим для всех семейных периодических лихорадок является повышение содержания ИЛ-1, который играет ключевую роль в их патогенезе. Соответственно, для лечения TRAPS и других моногенных аутовоспалительных заболеваний применяют ингибиторы ИЛ-1, в частности канакинумаб, эффективность которого подтверждена в двойном слепом, плацебо-контролируемом исследовании. Длительная терапия такими препаратами необходима не только для предупреждения приступов, но и профилактики развития АА-амилоидоза.
Используемые источники
- Williamson LM, Hull D, Mehta R, et al. Familial Hibernian fever. Q J Med 1982;51(204):469-80.
- McDermott MF, Aksentijevich I, Galon J, et al. Germline mutations in the extracellular domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell 1999;97(1):133-44.
- Моисеев С.В., Рамеев В.В. Дифференциальный диагноз системных аутовоспалительных заболеваний. Клин фармакол тер 2022;31(2):5-13 [Moiseev S, Rameev V. Differential diagnosis of systemic autoinflammatory diseases. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2022;31(2):5-13 (In Russ.)].
- Doria A, Zen M, Bettio S, et al. Autoinflammation and autoimmunity: bridging the divide. Autoimmun Rev 2012;12(1):22–30.
- Szekanecz Z, McInnes I, Schett G, et al. Autoinflammation and autoimmunity across rheumatic and musculoskeletal diseases. Nat Rev Rheumatol 2021;17:585-95.
- Cudrici C, Deuitch N, Aksentijevich I. Revisiting TNF receptor-associated periodic syndrome (TRAPS): current perspectives. Int J Mol Sci 2020;21(9):3263.
- Lachmann HJ, Papa R, Gerhold K, et al. The phenotype of TNF receptor-associated autoinflammatory syndrome (TRAPS) at presentation: a series of 158 cases from the Eurofever/EUROTRAPS international registry. Ann Rheum Dis 2014;73(12):2160-7.
- Nakamura Sh, Yoshimori T. Autophagy and longevity. Mol Cells 2018;41:65-72.
- Toplak N, Frenkel J, Ozen S, et al. An international registry on autoinflammatory diseases: the Eurofever experience. Ann Rheum Dis 201271(7):1177-82.
- Рамеев В.В., Симонян А.Х., Богданова М.В. и др. Периодическая болезнь: эволюция представлений о заболевании и подходы к диагностике и лечению. Клин фармакол тер 2020;29(2):56-68. [Rameev VV, Simonyan AKh, Bogdanova MV, et al. Familial Mediarranean fever: diagnosis and treatment. Kliniches kaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(2):56-67 (In Russ.)].
- Ter Haar NM, Eijkelboom C, Cantarini L, et al; Eurofever registry and the Pediatric Rheumatology International Trial Organization (PRINTO). Clinical characteristics and genetic analyses of 187 patients with undefined autoinflammatory diseases. Ann Rheum Dis 2019;78(10):1405-11.
- Schnappauf O, Aksentijevich I. Current and future advances in genetic testing in systemic autoinflammatory diseases. Rheumatology (Oxford) 2019;58(Suppl 6):vi44-55.
- Gattorno M, Hofer M, Federici S, et al; Eurofever Registry and the Paediatric Rheumatology International Trials Organisation (PRINTO). Classification criteria for autoinflammatory recurrent fevers. Ann Rheum Dis 2019;78(8):1025-32.
- Рамеев В.В., Моисеев С.В., Козловская Л.В. AA-амилоидоз при аутовоспалительных заболеваниях. Клин фармакол тер 2021;30(4):52-61 [Rameev V, Moiseev S, Kozlovskaya L. AA amyloidosis in autoinflammatory diseases. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(4):52-61 (In Russ.)].
- Рамеев В.В., Козловская Л.В., Рамеева А.С. и др. Анализ современной этиологии АА-амилоидоза и оценка влияния ее изменений на диагностику и подходы к лечению. Терапевтический архив 2021;93(6):672–8 [Rameev VV, Kozlovskaya LV, Rameeva AS, et al. The analysis of secondary AA-amyloidosis current etiology and its influence on the approaches for diagnosis and treatment. Terapevticheskii Arkhiv 2021;93(6):672–8 (In Russ.)].
- Brunger AF, Nienhuis HLA, Bijzet J, Hazenberg BPC. Causes of AA amyloidosis: a systematic review. Amyloid 2020;27(1):1-12.
- Ravichandran S, Lachmann HJ, Wechalekar AD. Epidemiologic and survival trends in amyloidosis, 1987-2019. N Engl J Med 2020;82(16):1567-8.
- Akse-Onal V, Sa E, Ozen S, et al. Decrease in the rate of secondary amyloidosis in Turkish children with FMF: are we doing better? Eur J Pediatr 2010;169(8):971-4.
- Laney T, Loeffler JM, Rowczenio DM, et al. AA amyloidosis complicating the hereditary periodic fever syndromes. Arthritis Rheum 2013;65:1116–21.
- Delaleu J, Deshayes S, Rodrigues F, et al. Tumor necrosis factor receptor-1 assciated periodic syndrome (TRAPS) related AA amyloidosis: a national case series and systematic review. Rheumatology (Oxford) 2021 Mar 14:keab252.
- Ter Haar N, Lachmann H, Еzen S, et al. Treatment of autoinflammatory diseases: results from the Eurofever Registry and a literature review. Ann Rheum Dis 2013;72(5):678-85.
- Bulua AC, Mogul DB, Aksentijevich I, et al. Efficacy of etanercept in the tumor necrosis factor receptor-associated periodic syndrome: a prospective, open-label, dose-escalation study. Arthritis Rheum 2012;64(3):908-13.
- De Benedetti F, Gattorno M, Anton J, et al. Canakinumab for the treatment of autoinflammatory recurrent fever syndromes. N Engl J Med 2018;378:1908-19.
- Romano M, Arici ZS, Piskin D, et al. The 2021 EULAR/American College of Rheumatology points to consider for diagnosis, management and monitoring of the interleukin-1 mediated autoinflammatory diseases: cryopyrin-associated periodic syndromes, tumour necrosis factor receptor-associated periodic syndrome, mevalonate kinase deficiency, and deficiency of the interleukin-1 receptor antagonist. Ann Rheum Dis 2022;81(7):907-21.
