Персонифицированный подход к ведению пациентов с болезнью Стилла взрослых: вызовы клинической практики
Болезнь Стилла взрослых – системное ревматическое заболевание, в основе которого лежит аутовоспаление, опосредованное интерлейкином (ИЛ)-1. В связи с низкой распространенностью и неоднородностью клинического течения, подходы к ведению пациентов с болезнью Стилла взрослых не унифицированы, а каждый клинический случай представляет собой особую задачу, которая, как правило, требует работы мультидисциплинарной команды, а также глубокого анализа опубликованной клинической практики. В представленной статье описаны дебют и тактика лечения болезни Стилла взрослых у молодой женщины во время беременности. Особенностями наблюдения были низкая эффективность стандартной терапии и развитие выраженной кожной реакции в местах введения антагониста рецептора ИЛ-1, что потребовало проведения десенсибилизации.
А.Л. Маслянский. Болезнь Стилла взрослых (БСВ) представляет собой системное аутовоспалительное заболевание неизвестной этиологии, основные клинические проявления которого включают ежедневные резкие подъемы температуры тела выше 39°C, артралгии или артриты, быстро исчезающую макулярную/макуло-папулезную кожную сыпь, лейкоцитоз с преобладанием нейтрофилов, гиперферритинемию [1,2]. Основную роль в патогенезе БСВ отводят чрезмерной секреции провоспалительных цитокинов, таких как интерлейкин (ИЛ)-1β, ИЛ-6, ИЛ-18, ИЛ-37, а также фактор некроза опухоли (ФНО)-α, интерферон (ИФН)-&gama; [2,3]. Эпидемиология БСВ остается недостаточно изученной. По данным мировой литературы, распространенность варьирует в пределах 1-34 случая на миллион человек с двумя пиками в возрасте 15-25 и 36-46 лет. Заболевание несколько чаще встречается у женщин [2-5].
Какие сложности возникают при диагностике болезни Стилла?
В.Ю. Мячикова. Клиническая картина БСВ характеризуется неоднородностью проявлений, отсутствием патогномоничных симптомов и специфических лабораторных маркеров. Наиболее распространенными симптомами, встречающимися более чем у половины пациентов, являются лихорадка >39°C, сыпь, артралгии, артрит, фарингодиния, лимфаденопатия и миалгии. Реже (>20%) наблюдаются спленомегалия, гепатомегалия, снижение массы тела и еще реже (<20%) – плеврит, перикардит и боль в животе. Артралгии и артрит чаще имеют характер полиартикулярного поражения. Чаще всего развиваются боли в коленных, голеностопных и лучезапястных суставах (>50%), реже – в локтевых, плечевых и межфаланговых (>20%) [5].
Описаны три варианта клинического течения БСВ:
1. Моноциклическое (19–44% пациентов) – единичный эпизод с системными проявлениями и (потенциально) поражением суставов, который продолжается более 2 мес, но менее 1 года и завершается устойчивой ремиссией. Ремиссия может быть достигнута с помощью нестероидных противовоспалительных препаратов (НПВП), глюкокортикостероидов или других иммуномодулирующих средств через несколько дней или недель.
2. Полициклическое или рецидивирующее (10–41%) – повторяющиеся рецидивы БСВ с интервалами от нескольких месяцев до нескольких лет на фоне иммуномодулирующего лечения или после его прекращения. В большинстве случаев отмечается сочетание поражения суставов и системных проявлений.
3. Хроническое (35–67%) – по крайней мере один эпизод стойких симптомов длительностью более 1 года, приводящий к хроническому и часто эрозивному поражению суставов с регулярными системными обострениями [3,6].
Также условно выделяют две формы БСВ – преимущественно системную (основные проявления – лихорадка и кожная сыпь) и преимущественно суставную (поражение суставов по типу ревматоидного артрита). В основе различия клинических проявлений, по современным представлениям, лежит гиперпродукция разных групп цитокинов [7]. Для системной формы характерны высокие уровни ИЛ-1β, ИЛ-18, ИЛ-4, ИФН-α/β, ИФН-&gama; и гиперферритинемия. При суставной форме хронического течения повышена активность ИЛ-17, ИЛ-23, ИЛ-6, ФНО-&alha;, тогда как уровни ИФН-g и ферритина снижены. В связи с этим при суставной форме может быть выше эффективность лечения блокаторами ФНО-α, а при системной – антагонистами ИЛ-1 или ИЛ-6 [6-8].
Для диагностики БСВ предложены различные диагностические критерии, основанные на сочетании клинических и лабораторных данных. Чаще всего используются критерии M. Yamaguchi и соавт. и B. Fautrel и соавт. (табл. 1). Ограничением первых являются критерии исключения (инфекции, злокачественные новообразования и другие ревматические заболевания), предполагающие широкое диагностическое обследование, которое может оказаться затруднительным в обычной клинической практике. Вторые критерии включают в себя определение фракции гликированного ферритина, которое мало доступно в медицинских учреждениях [3].
| Yamaguchi M. et al. [9] | Fautrel B. et al. [10] | |
|---|---|---|
| Примечание: PPV – positive predictive value (положительная прогностическая значимость); NPV – negative predictive value (отрицательная прогностическая значимость); ВГН – верхняя граница нормы; РФ – ревматоидный фактор, АНФ – антинуклеарный фактор | ||
| Критерии | 1. Лихорадка ≥39° С | |
| Большие | 1. Лихорадка ≥39°С более 1 нед. | 2. Артралгии |
| 2. Артралгии ≥2 нед. | 3. Транзиторная эритема | |
| 4. Лейкоцитоз ≥10×109/л, ≥80% нейтрофилов | 5. Относительное число нейтрофилов ≥80% | |
| 6. Фракция гликированного ферритина <20% | ||
| Малые | 1. Фарингит или боли в горле | 1. Типичная сыпь |
| 2. Лимфоаденопатия и/или спленомегалия | 2. Лейкоцитоз (≥10×109/л) | |
| 4. Отрицательные РФ и АНФ | ||
| Критерии исключения | Инфекции, злокачественные новообразования/паранеопластический синдром, аутоиммунные заболевания | Нет |
| Диагноз Оценка критериев |
Не менее 5 критериев, из которых не менее 2 больших Чувствительность 96,3%, специфичность 98,2%, PPV 94,6%, NPV 99,3% | больших критерия или 3 больших и 2 малых Чувствительность 87,0%, специфичность 98,8%, PPV 88,7%, NPV 97,5% [3] |
| Модифицированные критерии Yamaguchi: критерии Yamaguchi + ферритин > ВГН: чувствительность 100%, специфичность 97,1%, PPV 87,1%, NPV 100% | ||
| Альтернативные модифицированные критерии Yamaguchi: критерии Yamaguchi + гликированный ферритин ≤20%: чувствительность 98,2%, специфичность 98,6%, PPV 93,0%, NPV 99,6% [3] | ||
А.Л. Маслянский. Каковы современные подходы к лечению БСВ?
В.Ю. Мячикова. Международные рекомендации или согласительные документы, посвященные подходам к лечению БСВ, отсутствуют, хотя эта проблема обсуждается на уровне ряда национальных ревматологических ассоциаций, в частности в Японии [11] и Италии [12]. В российских рекомендациях по лечению ревматоидного артрита (2021 г.) БСВ упоминается как особая клиническая форма заболевания, однако подходы к оценке активности и лечению БСВ отдельно не сформулированы [13].
Препаратами первой линии в лечении БСВ считают системные глюкокортикостероиды в высоких начальных дозах, которые позволяют достичь клинического ответа примерно у 65% пациентов [5,6]. Учитывая риск развития нежелательных явлений, рекомендуются быстрое снижение дозы глюкокортикостероидов и полная их отмена через 6 мес или переход на поддерживающую дозу не более 5 мг/сут (в пересчете на преднизолон). Одновременно с глюкокортикостероидами рекомендуется назначить стероидсберегающую терапию базисными противовоспалительными препаратами (БПВП), которые препятствуют развитию стероидозависимости и стероидорезистентности и обеспечивают возможность более быстрого снижения дозы глюкокортикостероидов [5,14].
По данным ретроспективных исследований, предпочтительно применение метотрексата или циклоспорина А. Лечение метотрексатом было эффективным примерно в 60% случаев и в некоторых случаях позволяло полностью отменить глюкокортикостероиды без нарастания активности заболевания, однако уровень доказанности эффективности препарата пока недостаточный. Описаны отдельные примеры положительного опыта назначения азатиоприна, лефлуномида и гидроксихлорохина, однако польза их применения при БСВ также убедительно не доказана [4,5,14].
Ключевая роль ИЛ-1 и ИЛ-6 в патогенезе БСВ определяет интерес к применению генно-инженерных биологических препаратов (ГИБП), блокирующих эффекты этих цитокинов. Опубликовано большое количество клинических наблюдений, а также несколько рандомизированных клинических исследований, демонстрирующих эффективность блокаторов ИЛ-1 (анакинра, канакинумаб) и ИЛ-6 (тоцилизумаб) у пациентов с БСВ, хотя ни в одном из последних первичная конечная точка (основной критерий эффективности) не была достигнута [5,7,15,16]. По мнению исследователей, это могло быть следствием недостаточного количества пациентов и/или отсутствия валидированных критериев оценки активности БСВ.
В 2021 г. Национальный институт здравоохранения и совершенствования медицинской помощи Великобри тании (UK National Institute for Health and Care Excellence, NICE) рекомендовал применение блокатора ИЛ-1 анакинры для лечения БСВ с умеренной или высокой активностью или сохраняющейся активностью несмотря на прием НПВП или глюкокортикостероидов только при недостаточном ответе по крайней мере на два БПВП. Позже в том же году были опубликованы рекомендации Национальной службы здравоохранения Великобритании, в которых в качества препаратов третьей линии предложено использовать тоцилизумаб или анакинру [17,18]. По мнению немецких экспертов, анакинра или канакинумаб могут применяться для лечения БСВ до назначения БПВП. Роль ингибиторов ФНО-α в лечении пациентов с БСВ скромная и ограничивается лишь полиартикулярной формой БСВ с минимальными системными проявлениями заболевания в случае неэффективности других вариантов терапии [5].
А.Л. Маслянский. Описан ли дебют БСВ у беременных? Влияет ли беременность на выбор терапевтической тактики?
Е.С. Кувардин. Существуют данные о возможности развития БСВ во время беременности, однако их взаимосвязь остается до конца неясной [19,20]. А. Ida и соавт. предположили, что беременность может быть одним из фактором риска развития БСВ за счет повышенного уровня ИЛ-18 в сыворотке [21]. По данным китайского когортного исследования, в которое были включены 86 пациенток, БСВ более чем в 4 раза увеличивала вероятность спонтанного аборта и преждевременных родов. Кроме того, в случае развития БСВ во время беременности или после родов отмечалась тенденция к трансформации заболевания в форму полициклического течения [22].
Большинство пациенток с БСВ во время беременности получают терапию глюкокортикостероидами, которые в высоких дозах повышают риском осложнений у матери и плода. Применение БПВП во время беременности ограничено тератогенным и эмбриотоксическим эффектами большинства представителей данной группы препаратов. Безопасность терапии ГИБП у беременных изучена недостаточно, хотя описаны несколько случаев успешного применения блокаторов цитокинов, в частности анакинры, для контроля активности заболевания и минимизации использования глюкокортикостероидов [23-25].
Примером БСВ, резистентной к стандартной терапии, у беременной пациентки является следующее наблюдение.
А.А. Завражнова. Пациентка 28 лет, первая беременность. На сроке 11-12 недель беременности появились рецидивирующие эритематозные высыпания на коже бедер, проходившие самостоятельно без следа в течение нескольких часов. На протяжении последующих нескольких недель отмечала периодическое повышение температуры тела до 37,5оС и боли в горле. Позже, на фоне благоприятного течения беременности, наблюдались ежедневное повышения температуры тела до 39,0оС, артрит голеностопных суставов, артралгии, увеличение площади эритематозных высыпаний. Прово дилась терапия преднизолоном в дозе 40 мг/сут, которая привела к снижению температуры тела, уменьшению площади кожных высыпаний и суставного синдрома. Однако при регулярном приеме преднизолона в дозе 7,5 мг/сут сохранялись субфебрилитет, артралгии, лабораторные признаки воспаления: лейкоциты – 10,65×109/л (нейтрофилы – 8,81×109/л), С-реактивный белок (СРБ) – 87,16 мг/л, ферритин – 3516 мкг/л, незначительное повышение активности печеночных аминотрансфераз. При обследовании по месту жительства были исключены инфекционные причины заболевания. Глюко кортикостероиды были отменены. Принимала НПВП по мере необходимости.
На сроке 20 недель беременности была обследована в отделении ревматологии НМИЦ им. В.А. Алмазова. На основании клинических (лихорадка, полиартрит, кожные высыпания, боль в горле, лимфоаденопатия), лабораторных (нейтрофильный лейкоцитоз, острофазовая активность, гиперферритинемия) и инструментальных (спленомегалия) данных диагностирована БСВ в соответствии с критериями M. Yamaguchi и соавт. и B. Faut rel и соавт. [9,10].
Для лечения аутовоспалительных заболеваний, в частности семейной средиземноморской лихорадки, применяют колхицин, который считается безопасным во время беременности и кормления грудью. По современным представлениям, колхицин ингибирует образование NLRP3 инфламмасомы и, соответственно, снижает продукцию ИЛ-1α и ИЛ-18. Имеются описания успешного применения колхицина у пациентов с системным вариантом БСВ в случае неэффективности стандартной терапии, включая ГИБП, либо при невозможности ее назначения. Назначение колхицина вызывало уменьшение серозита и других системных проявлений заболевания, включая лихорадку, сыпь и артрит, у 65% пациентов и оказывало стероидосберегающее действие [26-31]. В связи с этим пациентке был назначен колхицин в дозе 0,5 мг/сут с последующим увеличением ее до 1 мг/сут. Тем не менее, на фоне терапии преднизолоном 15 мг/сут и колхицином 1 мг/сут сохранялась высокая активность заболевания.
Учитывая невозможность терапии метотрексатом и недостаточную эффективность преднизолона и колхицина, к терапии был добавлен блокатор ИЛ-1 короткого действия – анакинра в дозе 100 мг один раз в сутки подкожно. В инструкции по медицинскому применению указано, что анакинра (Кинерет) может применяться для лечения системной формы БСВ умеренной и высокой активности, а также при сохранении активности несмотря на лечение НПВП и глюкокортикостероидами. По рекомендации акушера-гинеколога был назначен низкомолекулярный гепарин в профилактической дозе. Присоединение анакинры привело к быстрой нормализации температуры тела, разрешению кожных высыпаний, боли в горле, суставного синдрома и нормализация лабораторных показателей.
На 12-е сутки от начала ежедневных подкожныхинъекций анакинры появились уртикарные зудящиевысыпания на коже предплечий, верхней трети груднойклетки и в области колен, которые отличались от ранеенаблюдавшихся кожных проявлений БСВ. Кроме того,увеличилась площадь гиперемии и отека в области инъекции препарата. Эти изменения были расценены какреакция гиперчувствительности на анакинру. Препаратбыл отменен, что привело через сутки к быстромунарастанию активности БСВ. Учитывая эффективностьблокатора ИЛ-1, отсутствие тяжелых и жизнеугрожающих нежелательных явлений, благоприятный профильбезопасности анакинры во время беременности и дляплода, было принято решение о возобновлении введения препарата с предварительным проведением десенсибилизации. Одновременно была увеличена доза преднизолона до 30 мг/сут и назначен топический глюкокортикостероид.
| День/инъекция | Объем | Разведение | Реакция на введение | Динамика проявлений |
|---|---|---|---|---|
| День 1 | 1:10000 | Без нежелательных явлений | Субфебрилитет, суставной синдром | |
| 1 | 0,1 | |||
| 2 | 0,2 | |||
| 3 | 0,4 | |||
| 4 | 0,8 | |||
| День 2 | 1:1000 | Единичные уртикарные высыпания | Нормализация температуры тела, разрешение болей в горле, суставного синдрома |
|
| 1 | 0,1 | |||
| 2 | 0,2 | |||
| 3 | 0,4 | |||
| 4 | 0,8 | |||
| День 3 | 1:100 | В течение суток повышение температуры тела до 37,7оС, уменьшение интенсивности высыпаний по наружной поверхности голеней |
||
| 1 | 0,1 | |||
| 2 | 0,2 | Локальная реакция в месте введения | ||
| 3 | 0,4 | |||
| 4 | 0,8 | |||
| День 4 | 1:10 | Нормотермия, снижение СРБ со 177,29 до 116,15мг/л | ||
| 1 | 0,1 | |||
| 2 | 0,2 | |||
| 3 | 0,4 | Локальная реакция в месте введения | ||
| 4 | 0,8 | |||
| День 5 | 1:10 | Одно эритематозное пятно диаметром до 1 см | Нормотермия | |
| 1 | 0,1 | |||
| 2 | 0,2 | |||
| 3 | 0,4 | |||
| 4 | 0,8 | |||
| День 6 | 1:5 | Без нежелательных явлений | Снижение СРБ до 53,33 мг/л | |
| 1 | 0,1 | |||
| 2 | 0,2 | |||
| 3 | 0,4 | |||
| 4 | 0,8 | |||
| День 7 | 1:1 | Одно эритематозное пятно диаметром до 1 см | СРБ 17,77 мг/л, уменьшение лейкоцитоза с 13,6 до 9,1×109/л |
|
| 1 | 0,1 | |||
| 2 | 0,2 | |||
| 3 | 0,4 | |||
| 4 | 0,8 | |||
| День 8-14 | 1:1 | Без нежелательных явлений | - | |
| 1 | 0,1 | |||
| 2 | 0,2 | |||
| 3 | 0,4 | |||
| 4 | 0,8 |
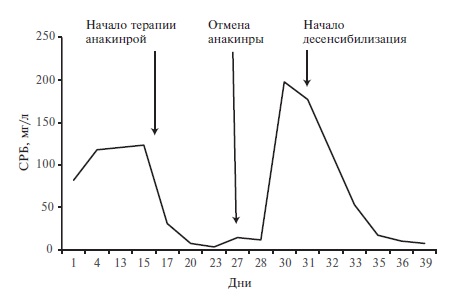
М.А. Андриянова. Десенсибилизация проводилась по следующей схеме: препарат в одном и том же разведении вводили 4 раза в день с интервалом около 4 ч, начиная с 0,1 мл. При последующих инъекциях объем раствора увеличивали вдвое, т.е. до 0,2, 0,4 и 0,8 мл, соответственно. Если на каком-то этапе отмечалась реакция, то следующую дозу не увеличивали. С каждым днем десенсибилизации уменьшали разведение препарата, ориентируюсь на его переносимость. Результаты десенсибилизации приведены в табл. 2. Через 2 недели после начала десенсибилизации местные реакции полностью разрешились, в связи с чем было возобновлено введение анакинры в дозе 100 мг один раз в сутки и начато постепенное снижение дозы преднизолона под регулярным врачебным и лабораторным контролем (рис. 1).
А.К. Хаджидис. В представленном клиническом случае для лечения БСВ применяли препарат анакинра, являющийся рекомбинантной формой антагониста рецептора ИЛ-1 человека. Анакинра конкурентно ингибирует связывание ИЛ-1α и ИЛ-1β с рецептором ИЛ-1 и тем самым нейтрализует активность ключевых медиаторов воспалительного процесса. По данным мета-анализа [32] и обзоров литературы [33], лечение анакинрой у пациентов с БСВ достаточно быстро приводит к стойкой клинико-лабораторной ремиссии, а также позволяет уменьшить дозы или прекратить прием глюкокортикостероидов и БПВП [34].
Наиболее распространенным побочным эффектом анакинры являются реакции в месте инъекции (эритема, экхимозы, воспаление, болезненность), которые в 5% случаев вынуждают отменить препарат. Описаны также анафилактические реакции во время инъекции и реакции замедленного типа (от макулопапулезной экзантемы до более редких тяжелых кожных реакций), которые возникают через несколько дней после приема препарата и обусловлены Т-клеточным механизмом [35].
Анакинра и другие блокаторы ИЛ-1 не одобрены для применения у беременных женщин и используются исключительно в тех случаях, когда польза лечения перевешивает возможный риск. М-E. Brien и соавт. проанализировали 88 случаев применения блокаторов ИЛ-1 анакинры и канакинумаба у беременных женщин. В 64,8% случаев беременность завершилась родами в срок без каких-либо акушерских/неонатальных осложнений, в 15,0% – преждевременными родами, в 1,1% – мертворождением. У 2 (2,5%) новорожденных была выявлена агенезия почек, у 6 (7,5%) – криопирин-ассоциированный периодический синдром. По мнению исследователей, блокада ИЛ-1 во время беременности не связана с увеличением частоты неблагоприятных перинатальных исходов, учитывая, что у всех женщин имелось аутовоспалительное заболевание, которое само по себе сопровождается высоким риском развития осложнений беременности [36].
Основаниями для назначении анакинры в представленном клиническом наблюдении были высокая активность заболевания, повышающая риск осложненного течения беременности и неблагоприятных исходов для плода, стероидорезистентность и отсутствие альтернативных препаратов. Лечение анакинрой осложнилось реакцией гиперчувствительности, однако проведение лекарственной десенсибилизации позволило продолжить терапию препаратом в адекватной дозе.
Я.И. Козлова. Широкое применение ГИБП в лечении ревматологической патологии, несомненно, значимо влияет на исходы заболевания, снижая частоту инвалидизации и смертность и повышая качество жизни пациентов. Однако наряду с выраженной эффективностью, врачи столкнулись с рядом побочных эффектов, в том числе реакциями гиперчувствительности [37,38], которые варьируются от легкого зуда до анафилаксии [39]. На основании классической классификации Gell и Coombs биологические агенты могут вызывать реакции гиперчувствительности типа I (немедленная гиперчувствительность, опосредованная IgE), реакции типа II (цитотоксические), реакции типа III (реакции сывороточной болезни) и реакции замедленного типа IV (тяжелые кожные реакции, такие как синдром Стивенса-Джонсона/эпидермальный токсический некролиз) [40]. Понимание механизма гиперчувствительности имеет решающее значение для определения дальнейшей терапевтической тактики.
Согласно отечественным и международным согласительным документам, "золотым стандартом" лечения лекарственной аллергии остается отмена препаратавиновника и применение альтернативного препарата, не обладающего перекрестной реактивностью [41-43]. Тем не менее, в определенных клинических ситуациях, как в нашем наблюдении, это невозможно. В таких случаях методом выбора остается индуцирование толерантности к препарату-виновнику путем проведения процедуры десенсибилизации [42]. Неиммуноопосредо ванные легкие кожные нежелательные реакции можно в ряде случаев предотвратить путем замедления скорости инфузии или премедикации H1-антигистаминными препаратами [38]. Однако в случае "истинной" IgE-опосредованной гиперчувствительности данные подходы менее эффективны, а нежелательные реакции после очередного воздействия препарата-виновника могут усиливаться, становясь опасными для жизни.
Для оценки механизмов реакций гиперчувствительности требуется проведение диагностических исследований, таких как кожное тестирование (in vivo) или тест активации базофилов (in vitro) [43]. При подтверждении IgE-опосредованных реакций возможна лекарственная десенсибилизация [37,38]. В настоящее время эксперты считают, что десенсибилизация целесообразна и может быть рекомендована в следующих случаях: препарат является терапией первой линии, альтернативное лечения отсутствует, препарат-виновник более эффективен, чем альтернативная терапия, неперекрестно реагирующие терапевтические средства недоступны [38,42].
Термин "лекарственная десенсибилизация" применяют для обозначения лечебного воздействия, при котором иммунный ответ пациента на лекарственный препарат модифицируется для создания временной толерантности [37,38]. В основе предполагаемых механизмов десенсибилизации лежит формирование ареактивности эффекторных клеток воспаления путем введения возрастающих доз соответствующего лекарственного препарата в течение короткого периода времени (от нескольких часов до нескольких дней). Таким образом подбирают максимальную переносимую пациентом и эффективную терапевтическую дозу лекарственного препарата и вводят ее далее весь необходимый период лечения.
Следует отметить, что в отличие от аллергенспецифической иммунотерапии атопических заболеваний основным эффектом десенсибилизации лекарственными препаратами считают именно снижение реактивности тучных клеток, базофилов и эозинофилов, а не формирование иммунологической толерантности. Ингибирующее воздействие на внутриклеточные сигнальные пути возрастающих доз "виновного" лекарственного препарата дезактивирует передачу сигнала и высвобождение медиаторов воспаления [44]. При этом ареактивность наблюдают только в период введения поддерживающей дозы препарата и непродолжительное время (несколько дней) после прекращения его приема. В настоящее время разработаны и внедрены в клиническую практику протоколы десенсибилизации у пациентов с аллергическими реакциями на антибиотики (преимущественно пенициллин), инсулины, сульфаниламиды, химиотерапевтические средства и ГИБП [45-47].
Результаты исследований свидетельствуют о том, что лекарственная десенсибилизация является не только безопасной, но и экономически выгодной процедурой [48,49]. За последние 20 лет у пациентов с различными ревматологическими заболеваниями накоплен опыт проведения десенсибилизации к ГИБП, в том числе блокаторам ФНО-a [50-52], ритуксимабу [53-56], тоцилизумабу [57,58], блокаторам ИЛ-17 (иксекизумабу) [59], блокаторам ИЛ-1 (анакинре) [60-64]. В большинстве клинических наблюдений десенсибилизацию проводили у пациентов с немедленными реакциями, однако опубликованы единичные сообщения об успешной десенсибилизации при отсроченных реакциях [65] и сывороточной болезни (реакция III типа) [66]. В нашей стране случаи проведения лекарственной десенсибилизации к ГИБП единичные.
В представленном нами клиническом случае препаратом выбора была анакинра, при повторном введении которой у пациентки возникли кожные высыпания, а также отек и выраженная гиперемия в месте инъекции. На сегодняшний день описаны несколько схем десенсибилизации при отсроченных реакциях, связанных с анакинрой. М. Verduga и соавт. использовали 18-дневную схему десенсибилизации у пациента с семейной средиземноморской лихорадкой [67], а V. Leroy и соавт. – протокол более быстрой десенсибилизации у пациента с БСВ [60]. G. Emmi и соавт. предложили безопасную и эффективную 4-дневная схему быстрой десенсибилизации, которую применили у 2 пациентов с тяжелыми отсроченными реакциями на анакинру в месте инъекции [64].
Таким образом, лекарственная десенсибилизация может проводиться у пациентов с лекарственной аллергией, которым необходимо продолжать прием препаратов, вызывающих реакции гиперчувствительности. Особое значение этот метод приобретает для ревматологических пациентов, в протоколы лечения которых все чаще включают высокоэффективные ГИБП. Последние обладают рядом преимуществ по сравнению с традиционными БПВП и часто представляют собой единственный возможный вариант лечения. Важно отметить, что десенсибилизацию лекарственными препаратами, в том числе ГИБП, должна проводить мультидисциплинарная команда специалистов с обязательным включением аллерголога-иммунолога, которая может обеспечить персонифицированный подход в каждой клинической ситуации.
А.Л. Маслянский. Данный клинический случай демонстрирует несколько важных аспектов применения анакинры для лечения БСВ: во-первых, возможность безопасного назначения данного препарата при беременности в случае торпидного течения заболевания, персистирования высокой клинико-лабораторной активности и/или развития стероидорезистентности и стероидозависимости; во-вторых, риск развития иммунных реакций, приводящих к лекарственной непереносимости; в-третьих, эффективность десенсибилизации, которая позволила продолжить прием анакинры и тем самым достичь ремиссии и сохранить беременность. Требуется дальнейшее изучение и накопление клинического опыта в отношении подходов к таргетной терапии БСВ в реальной клинической практике.
Используемые источники
- Firestein’s and Kelley’s Textbook of Rheumatology, 2-volume Set, 11th Edition, 2021: 682.
- Giacomelli R, Ruscitti P, Shoenfeld Y. A comprehensive review on adult onset Still’s disease. J Autoimmun 2018, 93:24–36
- Feist E, Mitrovic S, Fautrel B. Mechanisms, biomarkers and targets for adultonset Still’s disease. Nat Rev Rheumatol 2018;14:603-18.
- Efthimiou P, Kontzias A, Hur P, et al. Adult onset Still’s disease in focus: Clinical manifestations, diagnosis, treatment and unmet needs in theera oftargeted therapies. Semin Arthritis Rheum.2021;51(4):858-74.
- VordenbКumen S, Feist E, Rech, J. et al. Diagnosis and treatment of adult-onset Still’s disease: a concise summary of the German society of rheumatology S2 guideline. Z Rheumatol 2023;82(Suppl 2):81–92.
- Cush J, Medsger Jr TA, Christy WC, et al. Adult-onset Still's disease: clinical course and outcome. Arthritis Rheumatol 1987;30:186–94.
- Macovei LA, Burlui A, Bratoiu I, et al. Adult-onset Still’s disease - A complex disease, a challenging treatment. Int J Mol Sci 2022;23:12810.
- Maria AT, Le Quellec A, Jorgensen C, et al. Adult onset Still’s disease (AOSD) in the era of biologic therapies: Dichotomous view for cytokine and clinical expressions. Autoimmun Rev 2014;13(11):1149-59.
- Yamaguchi M, Ohta A, Tsunematsu T, et al. Preliminary criteria for classification of adult Still's disease. J Rheumatol 1992;19(3):424-30.
- Fautrel B. Adult-onset Still disease. Best Pract Res Clin Rheumatol 2008;22(5):773-92.
- Mimura T, Kondo Y, Ohta A, et al. Evidence-based clinical practice guideline for adult Still’s disease. Mod Rheumatol 2018;28:736–57.
- Colafrancesco S, Manara M, Bortoluzzi A, et al. Correction to: Management of adult-onset Still’s disease with interleukin-1 inhibitors: evidence and consensusbased statements by a Panel of Italian Experts. Arthritis Res Ther 2020;22:6.
- Клинические рекомендации МЗ РФ “Ревматоидный артрит”, 2021.
- Gerfaud-Valentin M, Jamilloux Y, Iwaz J, Seve P. Adult-onset Still's disease. Autoimmun Rev 2014;13:708–22.
- Galozzi P, Bindoli S, Doria A, Sfriso P. Progress in biological therapies for adultonset Still's disease. Biologics 2022;16:21-34.
- Kedor C, Listing J, Zernicke J et al. Canakinumab for treatment of adult-onset Still’s disease to achieve reduction of arthritic manifestation (CONSIDER): phase II, randomised, double-blind, placebo-controlled, multicentre, investigator-initiated trial. Ann Rheum Dis 2020;79(1090):1090-7.
- NICE. Anakinra for treating Still’s disease. Technology appraisal guidance [TA685]. 31 March 2021.
- Clinical Commissioning Policy. Tocilizumab for the treatment of adult-onset Still’s disease refractory to second-line therapy (adults) [210801P] (URN: 1609) First published: June 2018 Updated: August 2021 Version number: 2.0.
- PlaНais L, Mekinian A, Bornes M et al. Adult onset Still’s disease occurring during pregnancy: case-report and literature review. Semin Arthritis Rheum 2018;47:575-7.
- Abdulkarim S, Otieno F, Ali SK. Adult-onset Still’s disease triggered by pregnancy. Proc (Bayl Univ Med Cent) 2019;32:229-30.
- Ida A, Tsuji Y, Muranaka J, et al. IL-18 in pregnancy; the elevation of IL-18 in maternal peripheral blood during labour and complicated pregnancies. J Reprod Immunol 2000;47:65–74.
- Wang Z, Chi H, Feng T, et al. Pregnancy outcomes in patients with adult-onset Still's disease: A cohort study from China. Front Med 2020;7:566738.
- Imaizumi C, Saito M, Abe F et all. Adult-onset Still's disease during pregnancy treated with tocilizumab. Intern Med 2022;61(20):3137-40.
- Fischer-Betz R, Specker C, Schneider M. Successful outcome of two pregnancies in patients with adult-onset Still’s disease treated with IL-1 receptor antagonist (anakinra). Clin Exp Rheumatol 2011;29:1021–3..
- Smith C JF, Chambers CD, Five successful pregnancies with antenatal anakinra exposure. Rheumatology 2018;57:1271–5.
- Ozen S, Demirkaya E, Erer B, et al. EULAR recommendations for the management of familial Mediterranean fever. Ann Rheum Dis 2016;75:644-51.
- Asano T, Furuya M, Sato S, et al. Adding colchicine to immunosuppressive treatments; a potential option for biologics-refractory adult-onset Still's disease. BMC Res Notes 2018;11(1):320.
- Myachikova V, Moiseeva O, Konradi A, et al. A retrospective analysis of colchicine in combination with NSAIDs therapy in patients with systemic form of adult-onset Still's disease with serositis. Clin Exp Rheumatol 2022;40(8):1474-9.
- Ou-Yang L, Tang K. A case of adult onset Still's disease with mutations of the MEFV gene who is partially responsive to colchicine. Medicine (Baltimore) 2018;97(15):e0333.
- Rao S, Shi W. A case of adult-onset Still's disease accompanied with pulmonary tuberculosis successfully treated with colchicine. Postepy Dermatol Alergol 2021;38(5):912-5.
- Rao S, Tsang L, Zhao M, et al. Adult-onset Still's disease: A disease at the crossroad of innate immunity and autoimmunity. Front Med (Lausanne) 2022;9:881431.
- Ruscitti P, Ursini F, Cipriani P, et al. Biologic drugs in adult onset Still’s disease: a systematic review and meta-analysis of observational studies. Expert Rev Clin Immunol 2017;13(11):1089–97.
- Junge G, Mason J, Feist E. Adult onset Still’s disease: the evidence that antiinterleukin-1 treatment is effective and well-tolerated (a comprehensive literature review). Semin Arthritis Rheum 2017;47(2):295–302.
- Lyseng-Williamson KA. Anakinra in Still's disease: a profile of its use. Drugs Ther Perspect. 2018;34(12):543-53.
- Ali SB, Le T-T, Kette F, Hissaria P. Anakinra desensitisation in patients with cryopyrin-associated periodic syndromes Clin Exp Rheumatol 2021;39(1):13-6.
- Brien M-E, Gaudreault V, Hughes K, et al. A Systematic review of the safety of blocking the IL-1 system in human pregnancy. J Clin Med 2022;11(1):225.
- Madrigal-Burgaleta R, Guzman-Melendez MA, Alvarez-Cuesta E. Drug allergy desensitization is not a unique recipe. Curr Opin Allergy Clin Immunol 2022;22(3):167-74.
- Makowska J, Lewandowska-Polak A. Desensitization to biological agents used in rheumatology. Reumatologia 2020;58;1:26–33.
- Alvarez-Cuesta E, Madrigal-Burgaleta R, Broyles AD, et al. Standards for practical intravenous rapid drug desensitization & delabeling: A WAO Committee Statement. World Allergy Organ J 2022;15(6):100640.
- Pichler WJ. Adverse side-effects to biological agents. Allergy 2006;61:912-20.
- Клинические рекомендации РААКИ 2023.
- Bavbek S, Pagani M, Alvarez-Cuesta E, et al. Hypersensitivity reactions to biologicals: An EAACI position paper. Allergy 2022;77(1):39-54.
- Demoly P, Adkinson NF, Brockow K, et al. International Consensus on drug allergy. Allergy 2014;69:420-37.
- Sancho-Serra Mdel C, Simarro M, Castells M. Rapid IgE desensitization is antigen specific and impairs early and late mast cell responses targeting FceRI internalization. Eur J Immunol 2011;41:1004-13.
- Kang SY, Seo J, Kang HR. Desensitization for the prevention of drug hypersensitivity reactions. Korean J Intern Med 2022;37(2):261-70.
- Elfekih H, Hadjkacem F, Elleuch M, et al. Successful treatment of insulin allergy with desensitization therapy: A case report and literature review. Iran J Allergy Asthma Immunol 2019;18(5):572-83.
- Scherer K, Brockow K, Aberer W, et al. Desensitization in delayed drug hypersensitivity reactions – an EAACI position paper of the Drug Allergy Interest Group. Allergy 2013;68(7):844-52.
- Madrigal-Burgaleta R, Bernal-Rubio L, Berges-Gimeno MP, et al. A large singlehospital experience using drug provocation testing and rapid drug desensitization in hypersensitivity to antineoplastic and biological agents. J Allergy Clin Immunol Pract 2019;7(2):618-32.
- Berges-Gimeno MP, Carpio-Escalona LV, Longo-Munoz F, et al. Does rapid drug desensitization to chemotherapy affect survival outcomes? J Investig Allergol Clin Immunol. 2020;30(4):254-63.
- Puchner TC, Kugathasan S, Kelly KJ, Binion DG. Successful desensitization and therapeutic use of infliximab in adult and pediatric Crohn’s disease patients with prior anaphylactic reaction. Inflamm Bowel Dis 2001;7:34-7.
- Lelong J, Duburque C, Fournier C, et al. Desensitisation to infliximab in patients with Crohn’s disease. Rev Mal Respir 2005;22:239-46.
- Vultaggio A, Nencini F, Bormioli S, et al. Desensitization modulates humoral and cellular immune response to infliximab in a patient with an immediate hypersensitivity reaction. J Allergy Clin Immunol Pract 2020;8(5):1764-7.
- Madrigal-Burgaleta R, Berges-Gimeno MP, Angel-Pereira D, et al. Hypersensitivity and desensitization to antineoplastic agents: outcomes of 189 procedures with a new short protocol and novel diagnostic tools assessment. Allergy 2013;68:853-61.
- Behera SK, Selvarajan S, Mathews J, et al. A novel desensitization protocol for infliximab hypersensitivity in a 13-year old patient with pustular psoriasis. Curr Drug Saf 2019;14:158-62.
- Wong JT, Long A. Rituximab hypersensitivity: evaluation, desensitization, and potential mechanisms. J Allergy Clin Immunol Pract 2017;5:1564-71.
- Görgülü B, Seval GC, Kendirlinan R, et al. Rapid drug desensitization with rituximab in 24 cases: A single-center experience. J Investig Allergol Clin Immunol 2019;29:468-70.
- Erdogan T, Yasar Bilge NS, Kasifoglu T. Successful slow tocilizumab desensitization in a patient with adult onset Still disease. Biologicals 2018;55:17-8.
- Ye W, Fifield MC, Mayhew A, et al. Successful tocilizumab desensitization in an adult with juvenile idiopathic arthritis. Scand J Rheumatol 2016;45:75-6.
- Jimenez RB, Vera DG, Rivera-Diaz R, et al. Successful subcutaneous desensitization in a patient with allergy to ixekizumab. J Allergy Clin Immunol Pract 2018;6:1761-2..
- Leroy V, Lazaro E, Darrigade AS, et al. Successful rapid subcutaneous desensitization to anakinra in a case of delayed-type hypersensitivity reaction. Br J Dermatol 2016;174:14171418.
- Mendonca LO, Malle L, Donovan FX, et al. Deficiency of interleukin-1 receptor antagonist (DIRA): report of the first Indian patient and a novel deletion affecting IL1RN. J Clin Immunol 2017;37:445-51.
- YIImaz I, Türk M, Nazik Bahçecioğlu S. Successful rapid subcutaneous desensitization to anakinra in a case with a severe immediate-type hypersensitivity reaction. Eur Ann Allergy Clin Immunol 2018;50:94-6.
- Ali SB. Anakinra desensitisation in patients with cryopyrin-associated periodic syndromes Clin Exp Rheumatol 2021;39(1):13-6.
- Emmi G, Silvestri E, Cantarini L, et al. Rapid desensitization to anakinra-related delayed reaction: Need for a standardized protocol. J Dermatol 2017;44(8):981-2.
- Cortellini G, Mascella F, Simoncelli M, et al. Effective desensitization to tocilizumab in delayed hypersensitivity reaction. Pharmacology 2018;102:114-6.
- Fajt ML, Petrov AA. Desensitization protocol for rituximab- induced serum sickness. Curr Drug Saf 2014;9:240-2.
- Verduga MZ, Tavera MAU, Pereira DA, et al. Desensitization to anakinra case report. J Allergy Clin Immunol 2014;133:A
- Kang SY, Seo J, Kang HR. Desensitization for the prevention of drug hypersensitivity reactions. Korean J Intern Med 2022;37(2):261-70.
- Elfekih H, Hadjkacem F, Elleuch M, et al. Successful treatment of insulin allergy with desensitization therapy: A case report and literature review. Iran J Allergy Asthma Immunol 2019;18(5):572-83.
- Scherer K, Brockow K, Aberer W, et al. Desensitization in delayed drug hypersensitivity reactions – an EAACI position paper of the Drug Allergy Interest Group. Allergy 2013;68(7):844-52.
